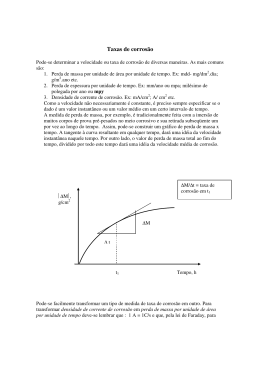
Corrosão Valentim M. B. Nunes Departamento de Engenharia Química e do Ambiente Março de 2009 Corrosão A corrosão metálica é um fenómeno electroquímico. Pode definir-se como a deterioração de um metal através de um processo electroquímico, com consequente perda de propriedades e funcionalidade. Estima-se que, em economias avançadas, o impacto económico associado à corrosão possa significar cerca de 3% do PIB! Corrosão do ferro Um exemplo familiar da corrosão, é a formação da ferrugem sobre o ferro, na presença de água e oxigénio. Ânodo: Fe(s) Fe2+(aq) + 2 eCátodo: O2(g) + 4 H+(aq) + 4 e- 2 H2O(l) Global: 2 Fe(s) + O2(g) + 4 H+(aq) 2 Fe2+(aq) + 2 H2O(l) 4 Fe2+(aq) + O2(g) + (4+2x)H2O(l) 2 Fe2O3•xH2O(s) + 8 H+(aq) ferrugem Corrosão do alumínio A corrosão atinge também outros metais. O alumínio tem um potencial de redução padrão inferior ao do ferro, logo tem maior tendência para sofrer oxidação. No entanto, o óxido que se forma (alumina: Al2O3) é não poroso (ao contrário da ferrugem) e protege o alumínio da corrosão. Medidas preventivas da Corrosão •Evitar o contacto com metais mais nobres (Eº maior) •Remover O2 e ar. •Reduzir a humidade, que contem substâncias corrosivas, como o CO2, SO2, SO3, etc. •Utilizar inibidores catódicos. •Revestir com materiais orgânicos. •Revestir metalicamente. •Passivar por anodização a superfície. •Vitrificar ou pintar a superfície. Revestimentos metálicos Revestimento do ferro com zinco, que é mais oxidável: Galvanização Revestimento com estanho. Enquanto houver estanho na superfície não ocorre corrosão do ferro. No entanto uma picada ou risco acelera a corrosão! Protecção catódica A protecção catódica é um processo no qual o metal a ser protegido é tornado o cátodo de uma pilha. A protecção de depósitos submarinos, canalizações subterrâneas, etc., é feita desta forma. Ânodo sacrificado Mg Mg2+ + 2 eO2(g) + 4H+ + 4 e- 2 H2O(l) Exemplos Protecção do betão armado de pontes. Protecção de estruturas metálicas imersas ou enterradas no solo. Protecção de navios. Efeito do pH - Diagramas de Pourbaix A corrosão depende também do pH do meio Potencial aplicado < -0.7 V (contacto com Zn ou Mg ferro fica imunizado. Potencial aplicado superior ferro sofre corrosão, dependendo do pH do meio. Diagrama de Pourbaix do Ferro
Baixar