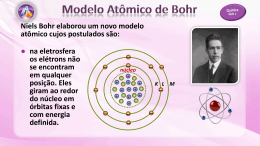
Modelos atômicos de Rutherford e Bohr 1. (MACK) Comemora-‐se, neste ano de 2011, o centenário do modelo atômico proposto pelo físico neozelandês Ernest Rutherford (1871-‐1937), prêmio Nobel da Química em 1908. Em 1911, Rutherford, bombardeou uma finíssima lâmina de ouro com partículas alfa, oriundas de uma amostra contendo o elemento químico polônio. De acordo com o seu experimento, Rutherford concluiu que a) o átomo é uma partícula maciça e indestrutível. b) existe, no centro do átomo, um núcleo pequeno, denso e negativamente carregado. c) os elétrons estão mergulhados em uma massa homogênea de carga positiva. d) a maioria das partículas alfa sofria um desvio ao atravessar a lâmina de ouro. e) existem, no átomo, mais espaços vazios do que preenchidos. 2. (UNIFOR) Considerando os resultados da experiência de Rutherford, que investigou a deflexão de partículas alfa em lâminas metálicas muito finas, pode-‐se afirmar que: I. Eles seriam os mesmos, se tivessem sido utilizadas lâminas metálicas espessas. II. A eletrosfera praticamente não impõe resistência ao movimento das partículas alfa. III. O fato de apenas uma pequena porção das partículas alfa terem sofrido grandes desvios indica que o núcleo é maciço e constitui a menor parte do átomo. É correto o que se afirma SOMENTE em a) I. b) II. c) III. d) I e II. e) II e III. 3. (UERJ) O laser (Light Amplification by Stimulation Emission of Radiation) é um dispositivo que amplia a absorção e emissão de energia pelos átomos, quando seus elétrons www.tenhoprovaamanha.com.br mudam de estados energéticos. O modelo atômico no qual os elétrons saltam para níveis mais energéticos devido a absorção de energia e liberam essa energia na volta para níveis menos energéticos é atribuído a: a) Demócrito b) Thonson c) Dalton d) Böhr e) Moseley 4. (UFPE) Em 1913, Niels Bohr propôs um modelo para o átomo de hidrogênio que era consistente com o modelo de Rutherford e explicava o espectro do átomo daquele elemento. A teoria de Bohr já não é a última palavra para a compreensão da estrutura do átomo, mas permanece como o marco do advento da teoria atômico-‐quântica. Em relação aos postulados e aplicações dessa teoria, podemos afirmar que: 00. o elétron movimenta-‐se ao redor do núcleo em órbitas circulares. 01. somente um número limitado de órbitas com determinadas energias é permitido. 02. ocorre necessariamente emissão de luz quando o elétron salta de uma órbita para outra. 03. a teoria de Bohr explica com precisão, exclusivamente, o espectro do átomo de hidrogênio. 04. a teoria de Bohr pode ser aplicada com sucesso na interpretação do espectro de íons como He+ e Li2+ , que contêm um único elétron. GAB: 1. [E] 2. [E] 3. [D] 4. VVFFV 1
Baixar