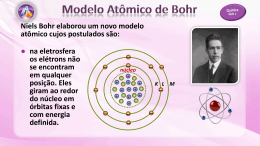
Ensino Médio – Unidade Parque Atheneu Professor (a): Aluno (a): Izabel Marques. Série: 3ª Data: ____/ ____/ 2014. LISTA DE QUÍMICA I 1) Qual foi o modelo atômico proposto por Rutherford? Quais são as partículas subatômicas fundamentais? Construa uma tabela relacionando as partículas às regiões onde elas estão localizadas no átomo sua massa e carga relativa. 2) Qual é o modelo atômico atual? Faça um resumo sobre tal modelo, destacando suas principais descobertas. (Obs.: Não se esqueça de citar os cientistas responsáveis pelas respectivas descobertas) 3) O conhecimento sobre estrutura atômica evoluiu à medida que determinados fatos experimentais foram sendo observados, gerando a necessidade de proposição de modelos atômicos com características que os explicassem. Escreva as características do modelo: Dalton; Thomson; Rutherford e Bohr, respectivamente 4) Apesar de suas amplas aplicações, o aparelho de Raios X deve ser usado com cautela. Em especial, recomenda-se evitar a superexposição em crianças e adolescentes, pois pode provocar problemas para os seus descendentes. Explique por que os Raios X podem ser nocivos ao ser humano e também por que se deve evitar seu uso em crianças. 5) Em 1911, Rutherford e colaboradores realizaram o experimento mostrado na figura abaixo: I- a maioria das partículas α, sem sofrer algum desvio, atravessaram livremente a lâmina, produzindo cintilações na chapa fluorescente. II- ocasionalmente, porém, algumas partículas α eram desviadas de sua trajetória, ao atravessarem a lâmina, produzindo cintilações em pontos afastados da região de incidência da grande maioria das demais partículas α. III- muito raramente, algumas partículas α eram refletidas ao incidir sobre a lâmina de ouro. CARVALHO, Geraldo Camargo de. Química moderna. São Paulo: Scipione, p. 15. (Adaptado). Sabendo que as partículas α são carregadas positivamente e de acordo com o contexto e as informações apresentadas na figura: a) comente como as observações colhidas no experimento contribuíram para Rutherford propor o seu modelo atômico. b) comente a falha do modelo de Rutherford, segundo a física clássica, e como Bohr aprimorou esse modelo. 6) Considerando o modelo atômico de Rutherford-Bohr, como se explica a emissão de luz colorida pela detonação de fogos de artifício? Unid. Parque Atheneu (62) 3273 – 0040 – www.colegiointerativa.com.br – e-mail: [email protected] 7) Com base nas teorias atômicas de Dalton e Bohr, responda às questões apresentadas a seguir. a) A teoria atômica de John Dalton foi publicada em 1804. Duas idéias importantes expressas nessa teoria estão listadas a seguir. De que maneira o atual entendimento da teoria atômica difere de cada uma dessas duas idéias? I- Toda a matéria é composta de partículas minúsculas e indivisíveis, chamadas átomos. II- Átomos de um mesmo elemento são idênticos em todos os aspectos. b) Em 1913, o físico dinamarquês Niels Bohr propôs uma teoria para explicar o espectro de emissão do hidrogênio. Essa teoria postulava que: · o elétron no átomo de hidrogênio girava em torno do núcleo em órbitas fixas. · cada órbita representava um estado fixo de energia. · órbitas mais próximas do núcleo tinham menor energia que as órbitas mais afastadas. De modo geral, como a atual compreensão da estrutura eletrônica dos átomos difere daquela proposta por Bohr para o átomo de hidrogênio? 8) Observe o trecho da história em quadrinhos a seguir, no qual há a representação de um modelo atômico para o hidrogênio. WATCHMEN. São Paulo: Abril. Qual o modelo atômico escolhido pelo personagem no último quadrinho? Explique-o. 9) A fabricação de fogos de artifício requer um controle rigoroso das variações do processo como, por exemplo, a proporção dos componentes químicos utilizados e a temperatura de explosão. A temperatura necessária para acionar os fogos de artifício de médio e grande porte é de cerca de 3600 ºC. É a geração desse calor que é responsável pela produção de ondas luminosas, pois provoca a emissão atômica, ou seja, a emissão de luz que ocorre quando o elétron sofre uma transição de um nível mais energético para outro de menor energia. Considerando este assunto, responda aos itens abaixo: a) A qual modelo atômico esse fenômeno de emissão de luz está ligado? b) Explique esse fenômeno de emissão de luz em termos de elétrons e níveis de energia. 10) O sucesso do modelo atômico de Niels Bohr estava na explicação da emissão de luz pelos átomos. A emissão de luz é provocada por uma descarga elétrica através do gás sob investigação. Bohr desenvolveu um modelo do átomo de hidrogênio que lhe permitiu explicar esse fenômeno. a) Descreva o modelo de Bohr. b) Descreva o que ocorre, segundo o modelo do átomo de Bohr, com o elétron do hidrogênio quando submetido à descarga elétrica. Atenção ao prazo de entrega das listas!!!Bom final de Semana!!! Unid. Parque Atheneu (62) 3273 – 0040 – www.colegiointerativa.com.br – e-mail: [email protected]
Baixar