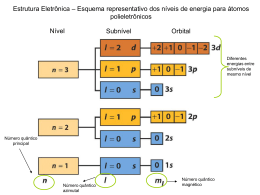
Química Ι-B Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção 1. Atomística O ÁTOMO : CONSTITUIÇÃO, RELAÇÕES NUMÉRICAS E CARACTERIZAÇÃO 1.1. Constituição núcleo: prótons (p) e nêutrons (n) Átomo eletrosfera: elétrons (e) 1.2. Relações Numéricas a. de tamanho • raio (r) atômico … r ≅ 1Å (ordem de grandeza), onde: 1Å = 10-10m • raio (rn) do núcleo … r = 104 rn b. de massa PARTÍCULA Próton (p) Nêutron (n) Elétron (e) g 1,67 . 10-24 1,67 . 10-24 9,11 . 10-28 u (u.m.a.) 1,007276 1,008665 0,0005486 Observações: • • c. mp ≅ mn ; mp ≅ 1836 me 1 do 12 1u= 6C 12 ⋅ massa ( ) de carga elétrica PARTÍCULA UNIDADE (RELATIVA) DE CARGA ELÉTRICA +1 0 -1 C +1,602 . 10-19 0 -1,602 . 10-19 Próton (p) Nêutron (n) Elétron (e) Observação: • • Np = Ne Np ≠ Ne → → átomo (neutro) íon Np > Ne → cátion Np < Ne → ânion Um átomo transforma-se em íon por meio de perda ou ganho de elétrons: • • X Y → X+2 + e- → + Y- 2e(átomo transformando-se em íon dipositivo); (átomo transformando-se em íon mononegativo). 1 Química Ι-B Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção Atomística 1.3 Caracterização A ZX A (número de massa) ; A = Np + Nn Z (número atômico) ; Z = Np Um elemento químico é um conjunto de átomos com mesmo número atômico (Z), podendo existir átomos do mesmo elemento com números de massa (A) diferentes. Exemplo: 2. 35 17 Cl e 37 17 Cl (isótopos do elemento cloro) MASSA ATÔMICA (M.A.) A massa atômica e a ocorrência de um isótopo pode ser determinada em um espectrógrafo de massa. A massa atômica (M.A.) de um elemento é a média ponderada entre as massas atômicas de seus isótopos. Exemplo: 63 65 Cu Cu ... ... M.A. (Cu) = M.A. = 62,930 u ; ocorrência = 69,09% M.A. = 64,928 u ; ocorrência = 30,91% 62,930 ⋅ 69,09 + 64,928 ⋅ 30,91 100,00 → M.A. (Cu) = 63,55 u Observações: • Na maioria dos problemas, a M.A. de um isótopo, em u ou u.m.a., pode ser considerada aproximadamente igual ao seu número de massa. M.A. (63Cu) ≅ 63 u ; M.A. (65Cu) ≅ 65 u. • A massa de um isótopo ou a massa média de um elemento, em gramas, pode ser obtida dividindo-se a massa atômica, em u ou u.m.a., pela constante de Avogadro (NA = 6,02 . 1023 mol-1). 62,930 ⇒ m = 1,05 . 10-22 g Massa do 63Cu, em gramas: m = 23 6,02 ⋅ 10 2 Química Ι-B Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção Atomística EXERCÍCIOS PROPOSTOS 1. Determine o número de prótons, nêutrons e elétrons presentes nas seguintes partículas: a) 39 19 K b) c) d) 35 − 17 Cl 27 3+ 13 Al 78 2− 34 Se 2. Sendo m e q , respectivamente, a massa e a carga do próton, calcule a massa e a carga de uma partícula alfa, em função de m e q. Dado: partícula alfa = 24He 2+ 35 Cl e 3. O cloro ocorre na natureza sob a forma de dois isótopos: 17 37 17 Cl . Sabendo que a massa atômica do cloro elementar é igual a 35,5 u, calcule as ocorrências percentuais dos isótopos do cloro. 4. Um átomo A ZX possui 77 nêutrons e apresenta massa igual a 2,19 . 10-22 g. Determine o número de massa (A) e o número atômico (Z) do átomo X. Dado: NA = 6,02 . 1023 mol-1. 5. Calcule a massa, em quilogramas, de um elétron. Dados: mpróton = 1836 melétron; NA = 6,02 . 1023 mol-1; Isótopo leve do hidrogênio = 11H . 3 Química Ι-B Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção 3. Atomística ESTUDO DA ELETROSFERA 3.1. Níveis de Energia # Definidos pelo número quântico principal (n = 1, 2, 3 ...). n=1 ... nível 1 ou K ; n=2 ... nível 2 ou L ; n=3 ... nível 3 ou M ; # n=7 ... nível 7 ou Q. 3.2. Subníveis de Energia Definidos pelos números quânticos principal (n = 1, 2, 3 ...) e azimutal ou de momento angular (A ∈ N ⏐ 0 ≤ A ≤ (n - 1)), onde: A = 0 → s ; A = 1 → p ; A = 2 → d ; A = 3 → f. n=1 ; A=0 → subnível 1s n.= 2 ; A=0 → subnível 2s n=2 ; A=1 → subnível 2p # n=3 ; # A=2 → subnível 3d # n=5 ; # A=3 → subnível 5f 3.3. Diagrama de Pauling Fornece o preenchimento da eletrosfera de um átomo, em ordem crescente de energia dos subníveis. 1s 2s 3s 4s 5s 6s 7s 2p 3p 4p 5p 6p 7p 3d 4d 5d 6d ENERGIA DO SUBNÍVEL: 1s < 2s < 2p < 3s < 4s < < 3d < 4p < 5s < 4d ... 4f 5f 4 Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção Química Ι-B Atomística 3.4. Orbital Região da eletrosfera onde o(s) elétron(s) apresenta(m) maior probabilidade de ser(em) encontrado(s). Definido pelos números quânticos principal (n), secundário ou azimutal (A) e magnético (m ou mA) , onde m ∈ Z | (-A) ≤ m ≤ (+A). Exemplo: n = 3 (M) A=0 (s) → m = 0 (s) A=1 m = -1 (p) → m = 0 (px) (py) m = +1 (pz) → A=2 m = -2 m = -1 (d) → m = 0 m = +1 m = +2 Observação: Número máximo de orbitais em um subnível = 2A + 1 ; número máximo de orbitais em um nível = n2. 3.5. Spin Sentido de rotação do elétron. Definido pelo número quântico de spin (ms). Valores de ms : ms = -1/2 ; ms = +1/2. 3.6. Princípio da Exclusão de Pauli “Um orbital pode comportar, no máximo, 2 (dois) elétrons (com spins opostos).” “Na eletrosfera de um átomo, não podem existir dois elétrons com os quatro números quânticos (n , A , m , ms) iguais.” Números máximos de elétrons nos Níveis e Subníveis • Níveis Nmax = 2n2 , onde n é o número quântico principal do nível. Exemplo: Nível N → n = 4 : Nmax = 2 . 42 = 32 • Subníveis Nmax = 4A + 2 , onde A é o número quântico azimutal do subnível. Exemplo: Subnível 3d → A = 2 : Nmax = 4 . 2 + 2 = 10 Observação: Números máximos de elétrons nos subníveis: s → 2 ; p → 6 ; d → 10 ; f → 14. 5 Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção Química Ι-B Atomística 3.7. Regra de Hund “Um orbital só poderá ser totalmente preenchido quando todos os orbitais do mesmo subnível estiverem semi-preenchidos.” Exemplo: 3d6 → → → ( 1 orbital completo e 4 orbitais semi-preenchidos ) → → ( 4 elétrons não emparelhados ). Observação: As maiores estabilidade ocorrem quando os orbitais de um subnível encontram-se totalmente preenchidos ou totalmente semi-preenchidos, respectivamente. Esta regra é válida principalmente para os subníveis d e f. Exemplo: A configuração nd10 é mais estável que a configuração nd9; a configuração nd5 é mais estável que a configuração nd4; a configuração nf14 é mais estável que a configuração nf13; etc. 6 Química Ι-B Universidade do Estado do Rio de Janeiro Campus Regional de Resende Engenharia de Produção Atomística EXERCÍCIOS PROPOSTOS 6. Qual o número máximo de elétrons em um nível M ? E se este for o último nível da distribuição eletrônica ? 7. Qual o número máximo de elétrons em um nível P ? E se este for o penúltimo nível da distribuição eletrônica ? 8. Represente um subnível n = 4; A = 1 com 5 elétrons segundo a notação usual. 9. Apresente a configuração eletrônica dos átomos seguintes, com base na ordem crescente de energia dos subníveis: a. 17Cl b. 26Fe c. 62Sm 10. Considerando o átomo de 27Co, determine: a. sua distribuição eletrônica, em ordem crescente de energia dos subníveis; b. sua distribuição eletrônica, em ordem crescente de número quântico principal (distância aproximada dos elétrons ao núcleo atômico); c. sua distribuição eletrônica , em níveis de energia (K, L, etc); d. as configurações eletrônicas em subníveis e níveis de energia dos íons Co2+ e Co3+; e. as configurações eletrônicas em subníveis do Co, Co2+ e Co3+ em função da configuração do gás nobre precedente. Dados: 2He , 10Ne , 18Ar , 36Kr , 54Xe , 86Rn. 11. Estabelecer a configuração do enxofre 16S em orbitais, utilizando a notação analítica (s, px, py, pz). 12. Determine o número de elétrons não emparelhados existentes nas seguintes partículas: (a) ; (b) 15P ; (c) 25Mn ; (d) 26Fe2+ ; 8O (e) 3+ 26Fe ; (f) 17Cl ; (g) 28O ; (h) 2+ 20Ca . 13. Estabelecer a configuração eletrônica em subníveis e níveis de energia para cada uma das seguintes partículas: (a) ; (b) 47Ag ; (c) 24Cr . 29Cu 7
Download