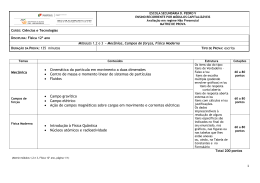
PROMOTOR Parceria Científica com a UNIVERSIDADE FERNANDO PESSOA Apresentação O objetivo deste curso é proporcionar uma formação avançada, bem como a aquisição de competências e conhecimentos, de forma sistematizada, nas áreas mais relevantes da regulação de medicamentos e produtos de saúde. Será emitido um certificado de participação para quem frequentar o curso completo, o qual será valorizado em futuros procedimentos concursais realizados pelo INFARMED, I.P. Os candidatos que concluam com sucesso esta formação estarão em melhores condições para poderem desempenhar funções profissionais nesta área ou para melhorar o seu desempenho profissional, caso já estejam a trabalhar na área em questão. O curso é composto por cinco módulos de formação, de funcionamento independente, ministrados por profissionais com larga experiência nestas matérias. Destinatários Profissionais de assuntos regulamentares ou titulares de grau universitário na área das ciências da saúde e da gestão. Candidatura, Inscrição e Seleção As candidaturas decorrerão das 10h00 do dia 12/10/2015 até às 00h00 do dia 18/10/2015 através do preenchimento de formulário eletrónico que será disponibilizado em www.infarmed.pt. Os candidatos serão seriados de acordo com a ordem da entrada da candidatura. As candidaturas aos módulos individuais serão feitas em datas posteriores, estando, no entanto, condicionadas à existência de vagas. O valor da inscrição é de 500 euros no total do curso (5 módulos), sendo a inscrição em módulos individuais de 100 euros por módulo. Aos candidatos selecionados serão dadas instruções sobre como proceder ao pagamento. 2 Vagas Participação restrita ao número máximo de 50 formandos, que ficarão distribuídos entre Lisboa e Porto. Horário e Local Os módulos formativos serão ministrados às sextas-feiras entre as 14:00 e as 18:00h. O curso decorre nas instalações do INFARMED, I.P. (para os inscritos em Lisboa) e da Universidade Fernando Pessoa (para os inscritos no Porto). A maioria das sessões será realizada em Lisboa, sendo transmitida em simultâneo por videoconferência para a Universidade Fernando Pessoa. Nos casos em que a sessão se realize no Porto, será efetuada a transmissão para o INFARMED, I.P.. Em ambos os casos estará assegurada a interatividade com os formadores. Cronograma A 1ª edição do Curso Avançado em Assuntos Regulamentares de Medicamentos e Produtos de Saúde decorrerá entre 30 de outubro de 2015 e 17 de junho de 2016. Coordenação Prof. Doutor Paulo Moreira Doutor em Health Management pela University of Manchester, Reino Unido. Director do International Journal of Healthcare Management (Taylor & Francis Group-Routledge, Oxford, RU) e Editor Científico para o Imperial College London (University Press). 20 anos de experiência internacional e nacional executiva e académica no sector da saúde que têm incluído funções e colaborações diversas ao nível de instituições internacionais técnicas e políticas incluindo de regulação e apoio aos sistemas de saúde europeus. Tem colaborado com várias universidades em Portugal, Suécia, Espanha, Inglaterra, EUA e Itália. Parcerias Científicas Universidade Fernando Pessoa 3 Módulos Curriculares O Curso Avançado em Assuntos Regulamentares de Medicamentos e Produtos de Saúde é composto por 5 módulos curriculares. Módulos Curriculares Horas I – Regulação no ciclo de vida do medicamento 24 II – Regulação de dispositivos médicos e produtos cosméticos 24 III – Farmacovigilância e vigilância de dispositivos médicos 24 IV – Sistemas de inspeção, controlo e verificação de conformidade 24 V – Avaliação de tecnologias de saúde 24 Total 120 Certificação A emissão de certificado final dependerá da participação num mínimo de 80% das horas de formação lecionadas. 4 Os conteúdos específicos planeados para cada Módulo Curricular serão os seguintes: Regulação no Ciclo de Vida do Medicamento . . . . . . . . . . . . . . . 24 Horas Conceitos gerais de regulação de medicamentos. Medicamentos: • Procedimentos para concessão de Autorização de Introdução no Mercado (AIM): nacionais e europeus • CMDh, articulação com PRAC • CHMP • Dossiê de AIM – estrutura e conteúdos • Bases legais de pedidos de AIM • Alterações aos termos da AIM – perspetiva reguladora e da indústria farmacêutica • Procedimentos de Arbitragem • Medicamentos genéricos • Medicamentos órfãos • Medicamentos pediátricos • Autorização de Utilização Especial e Autorização Excecional • Autorização de Importação Paralela Ensaios Clínicos Vertente regulamentar da Avaliação Científica (QSE) 5 Regulação de Dispositivos Médicos e Cosméticos . . . . . . . . . . . 24 Horas Conceitos gerais de regulação de produtos de saúde Dispositivos médicos: • Demarcação de fronteira e classificação de dispositivos médicos • Avaliação clínica/avaliação funcional • Requisitos essenciais e normalização • Plano de post-market surveillance (PMS) do fabricante • Avaliação de conformidade • Registo de dispositivos médicos Princípios gerais da regulação de produtos cosméticos: • Fabrico e importação • Notificação centralizada • Avaliação da segurança • Controlo do mercado de cosméticos Farmacovigilância e Vigilância de Dispositivos Médicos . . . . . . . 24 Horas Conceitos, enquadramento histórico e regulamentar: • Sistema Nacional e Europeu de Farmacovigilância • Sistemas de farmacovigilância e qualidade • Gestão e Notificação de Reações Adversas Medicamentosas (RAM) • Gestão de Sinal • Relatórios Periódicos de Segurança • Gestão do Risco e medidas de minimização • Monitorização adicional • Comunicação do risco Sistema de Vigilância de dispositivos médicos nacional e europeu 6 Sistemas de Inspeção, Controlo e Verificação de Conformidade . . . . 24 Horas Licenciamento de entidades: • Farmácias • Aquisição direta • Estupefacientes e psicotrópicos • Distribuidores por grosso de medicamentos de uso humano • Profissionais de saúde • Brokers • Distribuidores de substâncias ativas • Distribuidores por grosso de dispositivos médicos Inspeção a entidades e atividades: • Boas práticas de fabrico de medicamentos de uso humano, medicamentos veterinários e medicamentos experimentais • Boas práticas de distribuição de medicamentos • Boas práticas clínicas • Boas práticas de farmacovigilância • Boas práticas de farmácia hospitalar • Exercício farmacêutico • Boas práticas de fabrico e distribuição de dispositivos médicos Sistema de Alertas e Recolhas do mercado Comprovação da qualidade 7 Avaliação e Tecnologias de Saúde . . . . . . . . . . . . . . . . . . . . . . 24 Horas Sistema Nacional de Avaliação de Tecnologias de Saúde (SiNATS): • Regime de preços – mecanismos de formação e regulação • Avaliação de medicamentos • Avaliação de dispositivos médicos Avaliação farmacoterapêutica: eficácia/efetividade relativa Avaliação económica em saúde: • Introdução • Medição de custos e consequências • Análise crítica de estudos de avaliação económica 8 Comissão Científica e Pedagógica • Dr. Eurico Castro Alves • Dr.ª Paula Dias de Almeida • Prof. Doutor Paulo K. Moreira Formadores Peritos nacionais e internacionais na área da regulação de medicamentos e produtos de saúde, incluindo colaboradores e peritos do INFARMED, I.P. Informações Mais informações poderão ser obtidas através do e-mail: [email protected] 9
Baixar