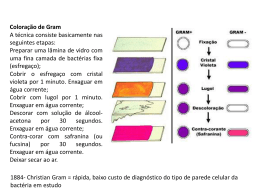
UNIVERSIDADE FEDERAL DA PARAÍBA PRÓ-REITORIA DE GRADUAÇÃO LICENCIATURA EM CIÊNCIAS BIOLÓGICAS À DISTÂNCIA ROTEIRO DE AULA PRÁTICA – EAD – BIOLOGIA DE MICRORGANISMOS Professor responsável: José Soares do Nascimento Pontuação: 20 Objetivo geral: Este conjunto de práticas em Microbiologia, proporcionará ao aluno visualizar os microrganismos na microscopia e em culturas, como ferramentas para se discutir os conceitos relacionados à morfologia, citologia, metabolismo e controle de microrganismos, especialmente bactérias e fungos. Objetivos específicos: estão evidenciados em cada prática descrita abaixo. Cronograna de atividades a ser realizadas no dia 08/05/2010 Horário (h) 08:00-09:00 09:00-10:00 10:00-10:30 10:30-11:30 Atividade Controle de microrganismos Coloração de Gram e de Zeehl Nelseen Antibiograma Identificação de fungos Valor da pontuação 5 5 5 5 OBS: É importante que os alunos utilizem jaleco ou batas, caso disponham. PRÁTICA 1: CONTROLE DE MICRORGANISMOS 1. OBJETIVOS: • Definir esterilização, desinfecção, antissepsia e assepsia • Definir os agentes bactericidas e bacteriostáticos • Verificar a eficiência dos agentes físicos e químicos sobre os microrganismos • Discutir sobre o mecanismo de ação dos agentes físicos e químicos 2. CONCEITOS: 9 ESTERILIZAÇÃO: Processo pelo qual se visa eliminar, por remoção ou morte, todos os microrganismos de um material ou meio. Prática fundamental em todos os procedimentos microbiológicos. Os materiais, a água, os vasilhames utilizados na preparação de meios de cultura e soluções nutritivas para o crescimento de microrganismo devem ser isentos de qualquer forma de vida. Assim, os termos estéril, esterilizar e esterilização referem-se à ausência total ou destruição total de todos os microrganismos. Ex: Flambagem, calor seco e calor úmido sob pressão (autoclavegem). 9 DESINFECÇÃO: Tratamento de objetos inanimados (utensílios, equipamentos, paredes, chão, mesas, etc.) com agentes químicos ou físicos, de forma a destruir a forma vegetativa dos microrganismos presentes. Ex: álcool 70%, Iodo, cloro, água em ebulição etc. 9 ANTISSEPSIA: Desinfecção dos tecidos vivos com antissépticos, as concentrações não podem ser tóxicas para o corpo. 9 ASSEPSIA: Conjunto de processos (técnicas) utilizados para impedir a entrada de microrganismos em local que não os contenha. 3. CLASSIFICAÇÃO DOS AGENTES DE CONTROLE: SECO – Forno ou estufa, flambagem, incineração CALOR ÚMIDO – autoclavação Fervura, tindalização e IONIZANTE – Raio-x e gama FÍSICOS RADIAÇÃO NÃO-IONIZANTE – Raios UV FILTRAÇÃO – Filtros com poros microscópicos (0,22µm) que tem capacidade de reter os microrganismos, os mais usados são de porcelana, cerâmica e papel celulose. QUÍMICOS GASES OU VAPORES (formaldeído, etc) OXIDANTES (água oxigenada, hipoclorito de sódio, etc) METAIS PESADOS (sulfato de cobre, mercúrio, etc) ÁLCOOL (70%) IODO GLUTORALDEÍDO FENÓIS Compostos quaternários de amônio 4. AÇÃO DE AGENTES FÍSICOS E QUÍMICOS SOBRE O CRESCIMENTO BACTERIANO 4.1-Efeito do calor sobre o crescimento bacteriano: Ação de água fervente a) Semear 0,5 mL da suspensão de E.coli em um dos quatro quadrantes de uma placa de Agar Mueller Hinton. Colocar o tubo com a suspensão de E. coli em água fervente por 5, 10 e 20 minutos. Após cada intervalo de tempo, realizar a semeadura em um dos quadrantes. Incubar as placas a 36oC/48h. b) Fazer o mesmo procedimento com uma cultura de Bacillus spp. ANOTAR O REULSTADO Interpretar os resultados: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 4.2-Efeito do calor sobre o crescimento bacteriano: a) Ação de calor úmido em vapor sob pressão: Inocular uma suspensão de E. coli e outra de Bacillus spp em caldo nutritivo e colocá-la no interior de uma autoclave à temperatura de 121°C por 15 a 20 minutos. Semear cada uma das culturas de Agar Mueller Hinton. ANOTAR O RESULTADO Interpretar os resultados: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 4.3- Efeito da Ação de antissépticos sobre o crescimento bacteriano a)Umedecer um swab estéril em água estéril, esfregar na mão e semear em um dos quadrantes da placa de Mueller Hinton.Umedecer um segundo swab em álcool iodado, passar na outra mão e aguardar por cinco minutos. Umedecer um outro swab água estéril, passar na mão desinfetada e semear em outro quadrante da placa. Repetir o procedimento do álcool iodado com sabão líquido. ANOTAR O RESULTADO ESTERILIZAÇÃO E. coli ANTISSEPSIA Bacillus FERVURA E. coli Bacillus GRUPOS Antes Depois Antes Depois Mão Sabão Álcool 0’5’10’20’ 0’5’10’20’ Suja + Iodo Interpretar os resultados: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 5. LEITURA DO CONTROLE DE MICRORGANISMOS PRÁTICA 2: COLORAÇÃO DE GRAM 1. OBJETIVOS • Corar uma lâmina pelo método de Gram; • Reconhecer bactérias Gram positivas e Gram negativas ao microscópio; • Compreender a importância dessa coloração para microbiologia clínica; • Compreender cada etapa do processo de coloração, bem como a função de cada substância utilizada. 2. INTRODUÇÃO: A técnica de coloração de Gram foi descoberta pelo físico dinamarquês Christian GRAM, em 1884. A Coloração de Gram é muito utilizada na bacteriologia permitindo a distinção entre bactérias Gram positivas (púrpura) e Gram negativas (rosa). A diferença entre os dois tipos de células relaciona-se com a estrutura da parede celular das bactérias. Assim a parede celular das bactérias Gram positivas é formada por uma camada espessa de peptideoglicano, enquanto que a parede celular das Gram negativas é formada por uma camada fina de peptideoglicano, rodeada por uma camada externa de lipopolissacarídeo e proteínas. Diferenças na permeabilidade dessas membranas aos reagentes químicos, levam a diferenças de coloração. Embora a grande maioria das bactérias possa ser corada por tal método, algumas não o fazem satisfatoriamente, exigindo técnicas especiais de coloração. Elas são as micobactérias, nocardias, espiroquetas, micoplasma, riquétsias e c1amídias. 3. MATERIAL • Placa de Petri contendo crescimento bacteriano • Lâminas para preparação do esfregaço • Solução salina • Alça de platina • Bico de bunsen • Bateria de corantes para o Gram 4. PREPARAÇÃO DO ESFREGAÇO • Limpar uma lâmina de vidro (passar algodão embebido em álcool) • Quando se tratar de uma cultura em meio líquido, com uma alça de inoculação, tomar uma pequena porção da cultura, observando as precauções de assepsia, e colocá-la sobre a lâmina espalhando-a para formar um esfregaço fino e uniforme. • Quando a cultura for em meio sólido,colocar uma gota de água destilada sobre a lâmina e com uma alça de inoculação, colher uma pequena quantidade de crescimento bacteriano da superfície do agar e suspendê-la na gota de água destilada, espalhando suficientemente para obter um esfregaço fino. • Deixar a lâmina secar à temperatura ambiente; • Fixar na chama do Bico de Bunsem, cortando a chama por 3x. 5. TÉCNICA DA COLORAÇÃO DE GRAM • Cobrir o esfregaço bacteriano com cristal violeta, deixar um minuto e verter o corante na cuba. • Remover o excesso da solução de cristal violeta da lâmina, lavando-a levemente com água corrente (opcional). • Cobrir o esfregaço com solução de lugol, deixar por um minuto e retirar a seguir, lavando com um filete de água. • Descorar o esfregaço usando uma solução de álcool acetona, rapidamente (10 a 15 segundos). • Lavar com água corrente, imediatamente. • Cobrir o esfregaço com a Fucsina, deixar por 30 segundos e retirar • Lavar com água corrente • Secar com papel absorvente * observar a lamina: colocar uma gota de óleo de imersão sobre o esfregaço corado e observar a lamina no microscópio, com objetiva de 100x 6. EXERCÍCIO PRÁTICO 1- Preparar um esfregaço com uma cultura sólida e líquida e corar pelo método do Gram. Visualizar e esquematizar a morfologia das bactérias existentes nas lâminas 7. INTERPRETAÇÃO DAS RELAÇÕES PELO MÉTODO DE GRAM Soluções em ordem de Gram Positivas aplicação Cristal violeta (CV) Células coradas em violeta Solução de lodo-Iugol (I) Formação do complexo CV_I no interior das células, que permanecem violeta.s Álcool Desidratação das paredes, celulares, diminuição da porosidade e da permeabilidade: o complexo CV-I não pode sair das células que permanecem violetas. Fucsina As células não são afetadas, permanecendo violetas. Gram Negativas Células coradas em violeta Formação do complexo CV_I no interior das células, que permanecem violeta.s Extração dos Iipídios da parede celular, aumentando a porosidade: O complexo CV-I é removido das células .. As células tomam o corante, tornando-se vermelhas. PRÁTICA 3: COLORAÇÃO DE ZIEHL NEELSEN 1. OBJETIVOS: • Executar a técnica de Ziehl Neelsen. • Classificar as bactérias de acordo com a coloração de Ziehl Neelsen. • Compreender a importância da solicitação de uma baciloscopia de Ziehl à partir de um material biológico, e saber interpretar o resultado da baciloscopia conforme o número de cruzes. 2. INTRODUÇÃO: Coloração de escolha para a observação de bactérias do gênero Mycobacterium, como, por exemplo, as espécies Mycobacterium tuberculosis e Mycobacteríum lepra e, bem como para cepas patogênicas de bactérias do gênero Nocardia. A parede das micobactérias possui uma espessa camada de Iipídeos (ácidos micólicos) que evita a penetração de diversos corantes. Por outro lado, quando o corante penetra alcançando o citoplasma da célula, ele não pode ser removido com facilidade, mesmo com o uso de álcool ácido. Por isso essas .bactérias são chamadas de BAAR (bacilos álcool ácido resistentes). Os bacilos da tuberculose são vistos como bacilos finos, retos, ligeiramente encurvados e geralmente, isolados; já os bacilos da lepra, agrupam-se em feixes denominados globias. O resultado da baciloscopia do escarro é dado em cruzes e depende da quantidade de bacilos encontrados em 100 campos microscópicos observados. Assim teremos: + (menos de 1 bacilo por campo) ++ (1 a 1O bacilos por campo) +++ (mais de 10 bacilos por campo) 3. MATERIAL • Lâminas para preparação do esfregaço • Solução salina • Alça de platina • Bico de Bunsen • Bateria de corantes para Ziehl Neelsen 4. TÉCNICA • Cobrir o esfregaço com fucsina de Ziehl e aquecê-la até emissão de vapores, mantendo o aquecimento por 5 minutos (tendo o cuidado para não deixar o corante ferver, nem secar). O bacilo da tuberculose e o da lepra só se cora após aquecimento. • Lavar com água corrente. • Descorar rapidamente com álcool-clorídrico a 3% até que não se desprenda mais corante. • Lavar com água corrente; ·Corar com azul de metileno- 1 minuto • Lavar com água corrente, secar com papel de filtro 5. EXERCÍCIO PRÁTICO 1- Como o bacilo da tuberculose se apresentou na lâmina de escarro corada pelo método de Ziehl Neelsen? 2- Por que, quando se suspeita de tuberculose, a coloração de Gram não é empregada para análise bacterioscópica do escarro na tentativa de identificação de micobactérias? PRÁTICA 4: ANTIBIOGRAMA 1. OBJETIVOS Ao o término desta aula, você deverá estar apto a: 1- Confeccionar um antibiograma na técnica de difusão com disco 2- Verificar a importância da solicitação de um antibiograma na prática médica. 2. INTRODUÇÃO Antibiograma é um teste utilizado para verificar a sensibilidade de uma bactéria frente a diversos antimicrobianos. Este teste tem como finalidade orientar o médico na terapêutica de modo que ela seja segura e eficaz. Para se fazer um antibiograma é necessário que o agente da infecção esteja isolado. A cultura precede o antibiograma. A maioria dos microrganismo apresenta uma variação muito grande quanto à sensibilidade, mostrando muitas vezes resistência múltipla a diversos antimicrobianos. Não é indicado antibiograma quando o microrganismo isolado faça parte da microbiota nomal do local onde o material clínico foi colhido, ou quando o microrganismo for considerado um contaminante. Existem várias técnicas para se fazer um antibiograma, onde a mais utilizada pela sua praticidade é o de difusão com disco: Difusão com discos: é a técnica mais utilizada - ( Método de Kirby e Bauer). Este método baseia-se na inibição do crescimento de um microrganismo semeado na superfície de um meio de cultura, onde se colocou discos de papel de filtro impregnado com um antimicrobiano de concentração padronizada A leitura é feita 18 a 24 horas após a incubação e se baseia na presença ou não de um halo de inibição ao redor do disco. Os halos de inibição são medidos em mm e a medição feita no fundo da placa. Os resultados são comparados com os de uma tabela, onde estão relacionados os tamanhos dos halos que significam sensibilidade ou resistência às drogas. Existem vários fatores que podem interferir no resultado do antibiograma levando com frequência a resultados falsos, entre estes podemos citar: • -Preparação imprópria do meio de cultura - o meio indicado para realização do antibiograma é O Agar Mueller Hinton, para bactérias exigentes que não cresce satisfatoriamente neste meio utilizamos o Agar Sangue. As placas devem ser colocadas na geladeira (2-8°C), e antes do uso colocá-las em estufa a 37° para eliminar o excesso de umidade. • Discos fora de validade ou impropriamente estocados - os discos devem ser mantidos na geladeira (2-8°C) e retirados um pouco antes do uso para que a temperatura seja equilibrada com a do ambiente. • Inóculo não padronizado - turvação da cultura deve ser ajustada a aproximadamente 1,5x108 bac/mL com o auxílio da escala 0,5 de Mc Farland. • Leitura prematura das placas antes de 16 - 18 • Medição errada dos diâmetros da zona de inibição. 3. MATERIAL • Cultura do microrganismo em agar • Placa de Mueller Hinton • Caldo Mueller Hinton • Swab • Discos para antibiograma • Pinça 4. TÉCNICA 1- Fazer uma suspensão da bactéria isolada com o caldo Mueller Hinton, obedecendo a diluição com a escala 0,5 de Mc Farland. 2- Umedecer o swab com a suspensão de microrganismo e semear espalhando na superfície da placa de agar Mueller Hinton. 3- Colocar os discos de antibióticos com a pinça pressionando-os levemente para que fiquem bem aderidos ao meio. 4- Incubar as placas na estufa à 36o C, por 18 a 24 hs 5- Observar o resultado e anotar 6- Comparar os resultados com a tabela padrão e classificá-los como resistentes, intermediários ou sensíveis. 5. EXERCÍCIO PRÁTICO 1. Realizar antibiograma utilizando a técnica acima descrita. Bactéria utilizada: __________________________________ Tabela de antibiograma: PRÁTICA 5: IDENTIFICAÇÃO MORFOLÓGICA DE FUNGOS 1. OBJETIVOS: Possibilitar ao aluno observar a morfologia de fungos e a mostrar as bases para a identificação de alguns gêneros. 2. INTRODUÇÃO: A identificação dos fungos é baseada quase que exclusivamente em sua morfologia tanto macro como microscopicamente. Macroscopicamente os fungos podem apresentar vários tipos morfológicos com colônias filamentosas, cotonosas, pulverulentas e outras (bolores) e cremosas (leveduras) e com os mais diversos tipos de pigmentos. A unidade estrutural dos fungos é representada pela hifa e o conjunto desses elementos é denominado micélio. O micélio pode ser diferenciado em vegetativo, quando exerce as funções de assimilação de alimentos e fixação em substratos e de frutificação que serve à reprodução dos fungos. O micélio vegetativo também pode se reproduzir. Estrutura vegetativa De acordo com a morfologia, apresenta 3 tipos: 9 Unicelular: Células arredondadas, ovóides ou alongadas, podendo se reproduzir por brotamento, cissiparidade ou por outro processo. Caracteriza as leveduras. 9 Filamentoso: Pode se apresentar com ou sem septos. As hifas podem se diferenciar em estruturas variadas, recebendo denominações diversas, conforme a sua função especial: rizóides, anastomoses, etc. Caracteriza os bolores. 9 Pseudofilamentoso: Algumas leveduras em determinadas condições formam, por brotamentos sucessivos, uma estrutura filamentosa conhecida com o nome de pseudohifas. Caracteriza as leveduras do gênero Candida. Micélio reprodutivo: O micélio vegetativo se diferencia em estruturas de reprodução caracterizadas pela formação de esporos que cumprem as funções de disseminação da espécie. Os esporos podem ser hialinos, pigmentados, simples, septados, apresentando várias formas que muitas vezes definem gêneros ou espécies de fungos. São muito importantes na identificação dos fungos. Os esporos, de acordo com sua origem, podem ser assexuados ou sexuados e tanto um com outro, podem estar ou não dentro de determinadas estruturas. 9 Esporos assexuados: o Esporos exógenos: formam-se na extremidade de hifas especiais denominadas conidióforos. Esses esporos são denominados conídios e caracterizam a Subdivisão Mitospórico. Ex. Aspergillus, Penicillium. o Esporo endógeno: esporos produzidos no interior de esporângios. Os esporos, nesse caso são chamados de esporangiósporos e caracterizam a subdivisão Zygomycoto e Chytridiomycota. Ex. Rhizopus, Mucor, Absidia. o 9 Esporos sexuados: o Esporos exógenos: esporos formados na extremidade de basídios e são denominados basidiósporos. Caracterizam a subdivisão Basidiomycota. Ex. cogumelos. o Esporo endógeno: esporos formados no interior de células denominadas ascos. Os esporos são chamados de ascósporos e caracterizam a subdivisão Ascomycota. Ex. Piedraia hortai. 3. MATERIAL Lâminas semi-permanentes com Aspergillus, Penicillium, Rhizopus e Curvularia Microscópio óptico. 4. MORFOLOGIA MICROSCÓPICA Descreva, através de lâminas prontas, os principais aspectos microscópicos dos fungos em questão. Aspergillus Penicillium Rhizopus Curvularia
Baixar