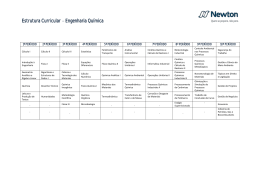
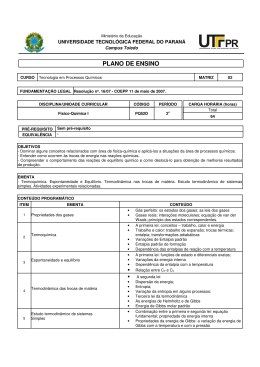
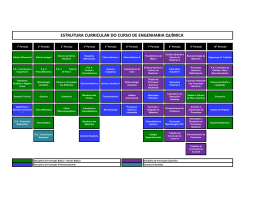
UNIDADE: INSTITUTO DE QUÍMICA DEPARTAMENTO: DE FÍSICO-QUÍMICA DISCIPLINA: FÍSICO-QUÍMICA VII CH TOTAL CRÉDITOS 60 Característica: CÓDIGO QUI 05-12444 Cursos: Obrigatória X 4 GEOLOGIA Eletiva restrita Eletiva definida Eletiva universal Carga Horária: Distribuição de carga horária da disciplina: Tipo de aula: do Aluno do Professor Teórica Semanal Semestral 04 60 04 60 Prática 60 h 60 h Laboratório Estágio Total Objetivos: Estudar as propriedades dos gases e suas leis empíricas, os princípios e conceitos da Termodinâmica e os principais diagramas de fases. Conceitos de outras disciplinas necessários para a aprendizagem desta disciplina: Pré-requisito(s) sugerido(s): Código: Pré-requisito: Química Geral e Inorgânica Código: Ementa: Definições e conceitos básicos.Estado gasoso: propriedades dos gases, leis empíricas para os gases ideais.Primeiro princípio da Termodinâmica.Transformações típicas.Termoquímica.Segundo princípio da Termodinâmica.Entropia e seu cálculo.Reversibilidade e irreversibilidade.Terceiro princípio da Termodinâmica.Diagramas de fases. Programa UNIDADE I: Gases Ideais. Propriedades dos gases. Leis empíricas para os gases ideais: lei de Boyle-Mariotte e lei de Charles & GayLussac. Equação de Clapeyron. Misturas de gases ideais: lei de Dalton. UNIDADE II: Conceitos fundamentais: energia, suas modalidades e transformações. Temperatura: escalas, medição, calor e quantidade de calor. Capacidade térmica. Sistemas termodinâmicos. Estado de um sistema. Equação de estado. Evolução de um sistema. Equivalente mecânico de calor. Trabalhos de expansão e compressão. Quantidades máxima e mínima de trabalho. Transformações irreversíveis. Primeiro princípio da Termodinâmica. Energia interna. Transformações: cíclicas e acíclicas. Tipos de transformações: isotérmica, isobárica e isométrica. Entalpia. UNIDADE III: Termoquímica. Definições. Calor de reação. Calor de formação. Lei de Hess. Estado padrão. Calor de dissolução e de diluição. Calor de combustão. Calorífico. Calor de reação a volume e pressão constantes. Variação do calor de reação com a temperatura. Energia de ligação. UNIDADE IV: Segundo princípio da Termodinâmica. Entropia segundo Clausius: desigualdade de Clausius. Tendência ao equilíbrio. Entropia nos processos irreversíveis e reversíveis. Variação de entropia em vários tipos de transformações. Entropia de um gás perfeito. Terceiro princípio da Termodinâmica. Variação da entropia nas reações químicas. UNIDADE V: Espontaneidade e equilíbrio. Condições gerais de espontaneidade e equilíbrio. Condições restritivas. Energia livre de Helmholtz e de Gibbs e suas propriedades. Equações fundamentais. UNIDADE VI: Diagramas de fases. Bibliografia (Clássica / Básica da área): - CASTELLAN, G. W.; Fundamentos de Físico-Química, Livros Técnicos e Científicos Ed. S.A., RJ, 1982 MARON, S. e PRUTTON, S.; Fundamentos de Físico-Química, Editorial Limusa Wiley, México BARROW, G. M.; Química Física, Ed. Reverte S.A., Espanha MOORE, W. J.; Físico-Química, Ao Livro Técnico S.A., RJ PILLA, L.; Físico-Química I e II, Livros Técnicos e Científicos Ed. S.A., 1980 ADAMSON, A. W.; Understanding Physical Chemistry, W. A. Benjamin, Inc. MACEDO, H.; Físico-Química, vol 1, Ed. Guanabara Dois, RJ, 1981 RODRIGUES, B. & BRAVO, M. (1983). Interpretação de Diagramas de Fases de Interesse Geológico. Faculdade de Ciências e Tecnologia. Universidade Nova de Lisboa. 163p. Professor proponente Data Assinatura/matr. Chefe do Departamento Data Rubrica Diretor Data Rubrica
Baixar