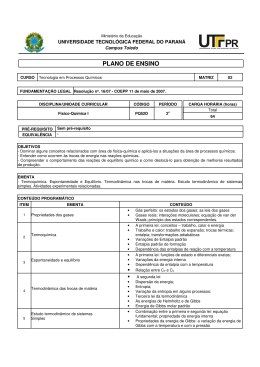
UNIVERSIDADE FEDERAL FLUMINENSE INSTITUTO DE QUÍMICA D ISCIPLINA : GFQ00018 D EPARTAMENTO DE F ÍSICO -QUÍMICA Conteúdo de Estudos: FÍSICO-QUÍMICA Carga Horária Total: 90 h FÍSICO-QUÍMICA IV - Código: 260-7 Teórica: 90 h Prática: - Estágio: - Disciplina: Obrigatória. Oferecida para o(s) Curso(s): Bacharelado em Química, Licenciatura em Química e Química Industrial. Objetivos da Disciplina: Compreender os conceitos fundamentais que permitem abordar os fenômenos químicos sob a ótica da Termodinâmica, preparando o aluno para o entendimento dos processos químicos. Descrever o comportamento dos gases. Descrição da Ementa: As propriedades dos gases. Definições termodinâmicas. As Leis da Termodinâmica e suas aplicações. Equilíbrio químico. A descrição termodinâmica de misturas. As propriedades das soluções. Diagramas de fases. Instrumentos de Acompanhamento e Avaliação: Listas de exercícios, testes, seminários e/ou outras atividades poderão ser realizadas em conjunto com as avaliações escritas no processo de acompanhamento da aprendizagem e da avaliação dos alunos. Conteúdo Programático: 1. Definições termodinâmicas; 2. Propriedades dos gases: gases ideais. Coeficientes diferenciais. Comportamento não-ideal. Isoterma de um gás real no plano pV;. A equação de van der Waals. O fator de compressibilidade e a lei os estados correspondentes. A equação do virial e outras equações de estado. Primeiro princípio da termodinâmica. Trabalho de expansão e compressão. A função de estado energia interna e o Primeiro Princípio da Termodinâmica. A função de estado entalpia. A relação entre Cp e Cv. O efeito Joule–Kelvin. Processos adiabáticos e politrópicos. Termoquímica. Convenções. Calor de reação. A Lei de Hess. Entalpia padrão de formação. Calor de combustão. A Lei de Kirchhoff. Temperatura adiabática de chama. Ponto de fulgor. Calor de solução. 3. Segundo Princípio da Termodinâmica: a função de estado entropia. Máquinas térmicas. O ciclo de Carnot. Propriedades da entropia. A variação de entropia nos processos irreversíveis. Função de Helmholtz. Função de Gibbs. Equação de Maxwell. Diagramas HT, Hp, ST, HS. Potenciais termodinâmicos. Equação de Gibbs–Helmholtz; 4. Terceiro princípio da termodinâmica: os postulados de Nernst e Planck. Entropia padrão de substâncias puras. A variação de entropia e entalpia livre nas reações químicas; GFQ00018 Página 1 de 1 5. Termodinâmica das substâncias puras: equação fundamental. Potencial químico de gases. Fugacidade. Variação de entalpia livre nas mudanças de fase. Os diagramas μT e μp. As equações de Clausius-Clapeyron e Antoine. Diagramas de fase para uma substância pura. O diagrama Tp. Polimorfismo. Diagrama pV e TV para substância pura. Transições de fase de segunda ordem; 6. Termodinâmica de sistemas multicomponentes: equações fundamentais dos sistemas abertos. A regra das fases de Gibbs. Grandezas parciais molares. A equação de Gibbs–Duhem. Grandezas de mistura. Soluções ideais. Tipos de soluções ideais. O equilíbrio líquido–vapor. A Lei de Raoult. Diagramas p-composição e T-composição. Propriedades coligativas das soluções. Solubilidade de gases em líquidos. Soluções não-ideais. Atividade e coeficiente de atividade. Soluções regulares. Propriedades coligativas. Equilíbrio líquido-vapor. Azeotropismo. Equações de Margules e Van Laar. Funções de excesso. Líquidos parcialmente miscíveis. Sistemas binários com azeótropo heterogêneo. Equilíbrio em fases condensadas. Análise térmica. Sistemas binários com temperatura eutética. Sistemas binários com formação de compostos. Sistemas que apresentam fusão incongruente. Sistemas ternários. Sistemas aquosos: soluções de dois sais com íon comum; 7. Equilíbrio químico: o grau de avanço de um sistema reacional. A condição geral do equilíbrio químico. A constante de equilíbrio em fase gasosa. A influência da temperatura e da pressão. Equilíbrio homogêneo em fase líquida. Equilíbrio químico heterogêneo. Bibliografia: - ATKINS, Peter W. Físico-Química. Rio de Janeiro: L.T.C., 1999. v. 1. - CASTELLAN, G. W. Fundamentos de Físico-Química. 1. ed. Rio de Janeiro: L.T.C., 1986. - MACEDO, H. Físico-Química I. Rio de Janeiro: Guanabara Dois, 1981. GFQ00018 Página 2 de 2
Baixar