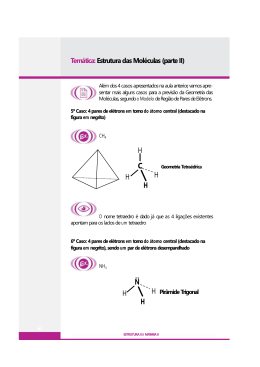
LIGAÇÃO QUÍMICA • O que causa a formação de uma ligação Química ? Surgem, então, os termos de energia potencial que descrevem a interação entre as partículas. Energia Potencial Repulsiva (entre partículas de mesma carga) Energia Potencial Atrativa (entre elétrons e núcleos) E =K ZeZe R12 Ze 2 E = −K re −n Por que se forma uma ligação química??? A ligação química irá se formar se houver uma queda na energia total do sistema, ou seja, há uma queda na variação da energia livre de Gibbs dos produtos em relação aos reagentes. Esta queda de energia se deve aos termos de energia potencial atrativos descritos anteriormente. Por exemplo, no caso da formação da molécula de H2 há uma queda de 436 kJ mol-1. ESTRUTURAS DE LEWIS • • • • • Determine o átomo central da molécula, caso ela possua mais de dois átomos. ( Normalmente é o átomo em menor quantidade na fórmula do composto, exceto o hidrogênio) Conte todos os elétrons de valência dos átomos que participam da molécula. No caso da molécula ser catiônica diminua um elétron do átomo central, para moléculas aniônicas acrescente um elétron a um dos átomos nas extremidades. Emparelhe os elétrons, disponha um par entre os átomos periféricos e o átomo central de forma a completar o octeto do átomo central. Caso o átomo central não complete o octeto ao formar ligações simples com os átomos da periferia atribua quantas ligações duplas forem necessárias para que o átomo central complete o octeto. Distribua os elétrons restantes em pares ao redor dos outros átomos da perifieria. Verifique se todos os átomos têm no mínimo 8 elétrons de valência, lembre-se átomos que não são do 1o e 2o períodos podem ter mais de 8 elétrons de valência, especialmente se forem os átomos centrais. ESTRUTURAS DE LEWIS RESSONÂNCIA • Uma única molécula pode ter mais de uma estrutura de Lewis satisfatória. Neste caso dizemos que a molécula têm fórmulas canônicas. • A estrutura real do composto não é nenhuma das fórmulas canônicas e sim uma mistura de todas elas, a esta estrutura mista chamamos híbrido de ressonância. SO2 SO42- O O O S S O O O O O O S O O O O S O O S O O O S O O ESTADO DE OXIDAÇÃO • • • • • • • • O número de oxidação (NOX) de um elemento na sua forma elementar é sempre zero. P4 : o P tem NOX = 0, O2: O tem NOX = 0, S8: S tem NOX = 0. O NOX de um íon simples é sempre a sua carga; Al3+ NOX=+3, I-: I tem NOX = -1. A soma de todos os NOX de todos os átomos em um composto neutro deve ser igual a zero. Para um íon complexo a soma deve ser igual a carga do íon. EX.: íon hexafluorfosfato: PF6-1 então ( NOX do P + 6 x NOX do F) = -1 Nos compostos o F têm estado de oxidação –1, quando os outros elementos do grupo 7A aparecem isoladamente ou em íons complexos, desde que não sejam os átomos centrais, o seu NOX é igual a -1. Elementos dos grupos representativos IA, IIA e IIIA geralmente têm carga igual a +1, +2 e + 3 respectivamente. O oxigênio geralmente têm NOX –2, mas pode ter NOX –1 em peróxidos como o H2O2, peróxido de hidrogênio, e NaO, peróxido de sódio. O hidrogênio geralmente tem NOX = +1, exceto nos hidretos de metais, por exemplo NaH, onde possui NOX = -1. CARGA FORMAL • Método 1: – Conte o número de elétrons de valência de cada átomo antes de participar do composto ( N1), conte o número de elétrons de valência depois de formar o composto supondo igual compartilhamento de elétrons das ligações (N2). – A carga formal sobre o átomo será N1-N2 • Método 2: – Conte N1, conte o número de elétrons de valência ao redor do átomo após formar o composto supondo que o átomo mais eletronegativo fica com o par de elétrons da ligação (N3). – A carga formal será N1-N3. Método de Allen ( Prof. Leland Allen da Princeton University ) – Carga formal = CF; Grupo da tabela periódica ao qual o átomo pertence = GTP; número de elétrons em pares não ligantes (NENL), χi = eletronegatividade de Pauling do átomo i; número de elétrons que fazem parte da ligação entre o átomo i e o átomo j = NL • CF = GTP − NENL − ∑ χ χi + χ i j xNL ij CARGA FORMAL Exemplo de Cálculo H H O χH = 2.1 χC = 2.5 χO = 3.5 Eletronegatividade e Polaridade de Ligação χA - χB 0.1 0.3 0.5 0.7 0.9 1.1 1.3 1.5 1.7 1.9 2.1 2.3 2.5 2.7 2.9 3.1 % i on i c ch ar act er 0.5 2 6 12 19 26 34 43 51 59 67 74 79 84 88 91 3.3 92 Polaridade de Ligações Químicas GEOMETRIA MOLECULAR TEORIA DA REPULSÃO DOS ELÉTRONS DE VALÊNCIA TRPEV Em 1957, o químico Ronald J. Gillepsie (1924-, Inglaterra) desenvolveu uma teoria que pode ajudar na previsão da geometria molecular através da TRPEV. Para se detrminar a geometria de um composto devem se seguir os seguintes passos: • A partir da fórmula química determinar a estrutura de Lewis • Classificar os pares de elétrons em torno do átomo central em ligantes e não-ligantes • Contar o número de pares de elétrons ligantes ao redor do átomo central c.1. Cada dupla e tripla ligação na TRPEV conta como um único par. • Utilizando a tabela na transparência seguinte é possível determinar a geometria molecular com razoável confiança. Esta Tabela é confeccionada baseando-se na minimização da energia da molécula pela minimização das repulsões entre os pares de elétrons, sendo que, repulsões que elvolvam ao menos um par de elétrons não ligante são mais fortes. bilbo.edu.uy/~dec/ecampos/catedra_inorganica/ general1/geometria/tapa.html www.chemistry.mcmaster.ca/extracts/ extracts99/ronald_gillespie/ # total de Pares de elétrons Ligantes em torno do átomo central # Pares de elétrons ñ-ligantes em torno do átomo central # Pares de elétrons ligantes em torno do átomo central Geometria Molecular Exemplo 2 0 2 Linear BeCl2;CO2 3 3 0 1 3 2 Trigonal Angular BCl3; CH3+, NOCl, SO2 4 0 1 2 4 3 2 Tetraédrica Piramidal Angular CH4, RSO32NH3, PH3 H2S, H2O 5 0 5 Bipirâmide trigonal ou Pirâmide de Base quadrada Gangorra Forma T Linear PF5 Octaédrica Pirâmide de base quadrada [CoCl6]4-; PF6IF5- Quadrangular ou quadrado plano XeF4, ICl4- 6 1 2 3 4 3 2 0 1 6 5 2 4 SCl4 IF3 XeF2 Geometria Molecular Molécula de amônia: 4 pares de elétrons ao redor do N, 1 par não ligante resultando em uma geometria piramidal. www.puc.cl/sw_educ/qda1106/CAP3/3C/3C1/ bilbo.edu.uy/~dec/ecampos/catedra_inorganica/ general1/geometria/tapa.html www.chemistry.mcmaster.ca/extracts/ extracts99/ronald_gillespie/ Geometria Molecular Geometria Molecular F B F F O Cl N Geometria Molecular I3- Geometria Molecular Glicina (Gly) Geometria Molecular Benzeno Naftaleno Coroneno GEOMETRIA MOLECULAR C60- Buckyminsterfulureno Momento de Dipolo da Ligação µ (D ) = q.r = (χ A − χ B ) 1D = 3,336 x10 −30 Cm Aqui estamos representando apenas a parte escalar de µ. Para o HCl temos q= e= 1,60.10-19C e r=1,36.10-10m Então µ=2.18.10-29 C.m=6,54D Mas o valor experimental é de 1,03D; então a separação de carga não é completa e a ligação não é totalmente iônica. HIBRIDIZAÇÃO e LIGAÇÃO QUÍMICA LOCALIZADA • Rigorosamente é uma forma de combinar as funções de onda eletrônicas(ψ) para induzir uma determinada geometria molecular. • Desta forma o número de funções de onda eletrônicas originais é o mesmo número de funções de onda hibridizadas (Φ). • Por exemplo para o BeH2, sabemos que a geometria da molécula é linear. Desta forma poderíamos gerar orbitais híbridos das ψ2pz e ψ2s da seguinte forma: • ψ2s + ψ2pz = Φsp1 e • ψ2s - ψ2pz = Φsp2
Download