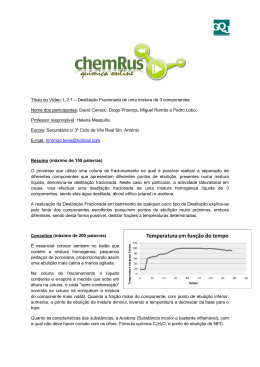
PROPRIEDADES: Hidróxido de Sódio – NaOH. Densidade: 2,3 g cm3 Massa Molar: 40,01 g mol-1. Ponto de Fusão: 318ºC Ponto de Ebulição: 1390ºC Toxicidade: Pode causar graves queimaduras na boca, garganta e estomago se inalado. Contato com pele causa irritações graves e queimadura e em contato com os olhos pode causar cegueira. A ingestão é fatal. Solubilidade: Completamente solúvel em água. Características: Líquido incolor e sem odor. Procedimentos em vazamentos: Conter o derramamento, ventilar o local, usar equipamento protetor pessoal apropriado, absorver em material absorvente como areia ou terra, lavar a área contaminada com água abundante. PROPRIEDADES: Hidróxido de Sódio – NaOH. Densidade: 2,3 g cm3 Massa Molar: 40,01 g mol-1. Ponto de Fusão: 318ºC Ponto de Ebulição: 1390ºC Toxicidade: Pode causar graves queimaduras na boca, garganta e estomago se inalado. Contato com pele causa irritações graves e queimadura e em contato com os olhos pode causar cegueira. A ingestão é fatal. Solubilidade: Completamente solúvel em água. Características: Líquido incolor e sem odor. Procedimentos em vazamentos: Conter o derramamento, ventilar o local, usar equipamento protetor pessoal apropriado, absorver em material absorvente como areia ou terra, lavar a área contaminada com água abundante. Processo de filtração PURIFICAÇÃO DO ÉTER ETÍLICO SECO II FILTRADO ÉTER ETÍLICO, traços de água, Fe2(SO4)3 (traços), CaCl2 (traços), FeSO4 (traços), H2SO4 (traços), 2 g de fios de sódio, em geladeira ao abrigo de luz. 1) filtrar em papel pregueado, recebendo em balão de destilação de fundo redondo com capacidade de 500 ml. O éter é altamente inflamável, tem p.e. ~ 35ºC e mais denso que o ar, é preciso eliminar qualquer chama que possa estar presente nas vizinhanças do local de trabalho. O aquecimento deve ser feito em banho-maria, com aquecedor elétrico ou manta elétrica. Volume do líquido na destilação: até 2/3 da capacidade do balão. DESCARTE EM FRASCO APROPRIADO FILTRADO ÉTER ETÍLICO SECO, traços de impureza não volátil. Fase sólida retida no filtro (NaOH, água, (traços), pequenos pedaços de sódio, éter etílico (traços). 9 Anotar o valor da pressão atmosférica; Durante a destilação não evaporar o éter até secagem total. 9 Determinar por comparação o volume de éter obtido, medindo 2) Destilar utilizando banho-maria como fonte com uma proveta seca; 9 Corrigir o valor experimental de p.e. para 1 atm e comparar com o valor da literatura. de calor em um sistema de destilação simples. Receber em frasco de kitassato contendo rolha e um tubo de borracha adaptado a saída lateral. Evitar superaquecimento do líquido além do seu p.e. normal. ÉTER ETÍLICO SECO DESTILADO (Produto final desejado) 3) Transferir para o frasco âmbar com rolha equipada com tubo de cloreto de cálcio anidro. O rótulo deve conter: nome do solvente, p.e./pressão atmosférica, nome do aluno e data. ÉTER ETÍLICO DESTILADO (EMBALADO E ROTULADO) ÉTER ETÍLICO SECO II Alunas: Camila Aparecida Cotrim Juliana Fernanda Almeida Castro 4º ano Licenciatura 2007 Assuntos Abordados Destilação Simples Fontes de Aquecimento Ponto de Ebulição Solventes mais comuns usados em química orgânica Parte Experimental II O que é destilação simples? Permite a separação de: 9 Um líquido de uma substância não volátil (tal como impurezas, p.ex.) 9 Separação de dois líquidos miscíveis entre si quando esses possuem uma diferença no ponto de ebulição. É uma técnica rápida, fácil e, se respeitado seus limites, eficaz. Comportamento da temperatura em destilações simples Mistura de dois componentes Condições de uso da Desti1ação Simples Não é possível separar completamente uma mistura. A destilação simples é aceitável quando: O ponto de ebulição de A e B tiverem uma diferença de aproximadamente 100ºC; A quantidade de B contida em A for muito pequena (<10%). Processo de Destilação Simples VÍDEO Fontes de Aquecimento BICO DE GÁS: Não dever ser usado para substâncias inflamáveis. Deve ser usado com tela de amianto para que o aquecimento seja praticamente uniforme e para evitar acidentes com a amostra. BANHOS: Banho-Maria e Banho de Óleo. MANTAS. CHAPAS TÉRMICAS. EVAPORADOR ROTATIVO (ROTAVAPOR) Onde a destilação simples não se aplica? AZEÓTROPOS Azeótropos Azeótropo de Mínimo ou Negativo Curiosidades Ponto de Ebulição Por que corrigir/padronizar o ponto de ebulição? O ponto de ebulição deve ser corrigido/padronizado devido as diferenças de pressões, entre a pressão local e a pressão ao nível do mar CORREÇÃO DO PONTO DE EBULIÇÃO 9 CÁLCULO PARA LÍQUIDOS NÃO ASSOCIADOS 9 CÁLCULO PARA LÍQUIDOS ASSOCIADOS Correção para líquidos não associados – Éter Etílico ΔT =O,00012 (760-p).(t+273) t760=ΔT + t ΔT: correção, em ºC a ser aplicada ao ponto de ebulição observado, t t: temperatura de ebulição observado no laboratório; p: pressão barométrica local t760: temperatura de ebulição a 760 mmHg (ponto de ebulição normal) Correção para líquidos associados – Água e Álcoois ΔT =O,00010(760-p).(t +273) t760=ΔT + t ΔT: correção, em ºC a ser aplicada ao ponto de ebulição observado, t t: temperatura de ebulição observado no laboratório; p: pressão barométrica local t760: temperatura de ebulição a 760 mmHg (ponto de ebulição normal) SOLVENTES MAIS COMUNS UTILIZADOS EM QUÍMICA ORGÂNICA PARTE EXPERIMENTAL ¾Fluxograma Referências Bibliográficas PAVIA, D.L; LAMPMAN, G.M; KRIZ, G.S. Introduction to organic laboratory techniques, third edition. http://www.qmc.ufsc.br/qmc5230/aula02/destsimples.html http://www.qmc.ufsc.br/organica/aula02/destilacao_simples.html http://labjeduardo.iq.unesp.br/ http://www.wellesley.edu/Chemistry/chem211lab/Orgo_Lab_Ma nual/Appendix/Techniques/SimpleDistill/simple_distillation.html http://pt.wikipedia.org/wiki/Aze%C3%B3tropo GONÇALVES, D.; WAL, E.; ALMEIDA, R.R. Química orgânica experimental 1988. Quando usar banho de óleo ou banhomaria?? Depende do ponto de ebulição da substância a ser destilada. Se P.E < 60ºC – Banho-maria. Se P.E >60º e <180ºC – Banho de Óleo. Com baixa pressão de vapor. ex.: óleo vegetal hidrogenado que não inflamam até 300ºC. (Óleo de semente de algodão) Se P.E > 180º – Bico de Gás
Baixar