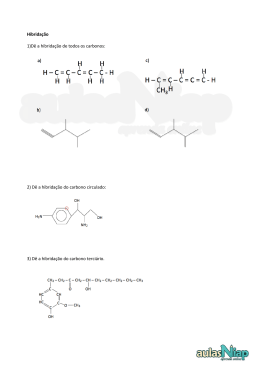
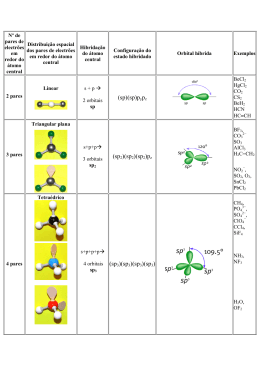
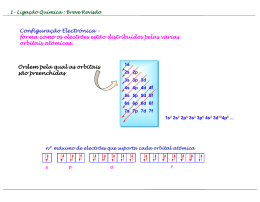
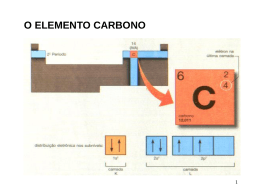
Aula 7 Poliatómicas II. Grupos Funcionais Ligação Química na Aproximação TEV (cont) Grupos Funcionais Hidrocarbonetos: Alcanos, Alcenos e Alcinos Estrutura Molecular, Tipos e Ângulos de Ligação Noções de Nomenclatura Momento Dipolar Outros Grupos Funcionais: Álcool, Éter, Aldeído, Cetona, Ácido Carboxílico, Éster, Amina e Amida Estrutura Molecular, Tipos e Ângulos de Ligação Noções de Nomenclatura Momento Dipolar BeH2 Estados Fundamentais - Be: 1s2 2s2 H: 1s1 Discutir (cont) • Série: BeH2, BH3,CH4, NH3, H2O • Hibridações e configuração electrónica, tipos e ângulos de ligação, pares isolados. Momento Dipolar. • Regra para prever tipo de hibridação: Átomo Central (Nº de ligações = nº de orbitais semi-preenchidas + nº de pares não ligantes) Geometria Linear CO2 Configuração electrónica do estado hibridado do Be Be: 1s2 2sp1 2sp1 py0 pz0 (assumindo eixo xx como internuclear) Ficam duas orbitais p “puras” hibridação sp ⇒ Geometria é linear Hibridação sp Ângulos = 180º BH3 Estados Fundamentais - B: 1s2 2s2 2p1 H: 1s1 Configuração electrónica do estado hibridado do B B: 1s2 2sp21 2sp21 2sp21 pz0 Fica uma orbital p “pura” hibridação sp2 ⇒ Geometria é triangular plana Hibridação sp3 Boro Ângulos 109º 28´ µ= 0 B Molécula Apolar Par Isolado Par Isolado Hibridação sp3 Hibridação sp3 Ângulos < 109º 28´ Ângulos < 109º 28´ 1 par isolado 2 pares isolados µ≠0 µ≠0 Molecula Polar Molécula Polar Hibridação sp3 Efeito dos Pares Não Ligantes Os electrões não ligantes estão localizados no átomo central ⇒ a área da carga negativa ocupa maior espaço. Os electrões ligantes são partilhados por dois Ângulo átomos ⇒ carga negativa é removida do átomo central. O efeito dos pares não ligantes Um par não ligante “ocupa mais espaço” junto do átomo central dado que a sua densidade electrónica não é partilhada por outros átomos, ao contrário do que se verifica no caso de haver uma ligação. Hibridações do Carbono Não hibridada Hibridação sp ↑ ↑ 2sp Hibridação sp2 ↑ ↑ ↑ 2sp2 Hibridação sp3 ↑ ↑ Par não ligante - Par não ligante Par ligante - Par ligante Devido as estas interacções observam-se ângulos menores que os esperados ↑ ↑ 2p 2s A intensidade relativa das forças repulsivas é: Par não ligante - Par ligante ↑↓ ↑ ↑ 2p ↑ 2sp3 ↑ 2p ↑ N ↑ ↑ ↑ 2sp3 ↑ 2s ↑ ↑ ↑ 2p ↑ ↑ ↑ sp3 C ↑ ↑ ↑ 2sp3 ↑↓ 3s ↑↓ ↑↓ ↑ 3p σ σ ↑ ↑ ↑ σ 1s H ↑↓ sp3 N σ 1s H 1s H hibridação sp3 Cl ↑↓ ↑↓ ↑↓ ↑ 3sp3 O σ + π sp2 ↑ 2s ↑↓ ↑ ↑ 2p σ σ ↑ Formação de uma ligação dupla sp2 ↑↓ ↑ 1s H 1s H Exercício – Esquematize a hibridação sp3 para os dois átomos seguintes (Cl e O) Átomo não hibridado ↑ ↑ ↑↓ C ↑ 2s ↑ ↑ 2p ↑ ↑↓ hibridação sp3 ↑ Átomo não hibridado CH3NH2 (exemplo hibridação sp3) ↑ Orbitais Hibridas sp3 ↑ ↑↓ ↑ ↑ 2sp3 As orbitais hibridas coalescem formando uma ligação sigma As orbitais p “puras” formam a ligação π H2C=NH Hibridação sp2 2s ↑ ↑ ↑ 2p N 2σ 1π ↑ ↑ ↑↓ ↑ ↑ ↑ 2sp2 ↑ 2p ↑ ↑ 2sp2 ↑ 2p sp2 C ↑ σ ↑ 2s ↑ ↑ 2p C 3σ 1π ↑ pC ↑ ↑ π σ ↑ pN ↑ ↑ ↑↓ σ σ ↑ ↑↓ hibridação sp2 ↑ Átomo não hibridado 1s H 1s H 1s H Hibridação sp2 Comparação entre as duas teorias para a Ligação Química TOM / CLOA ENLACE DE VALÊNCIA Combinam-se todas as OA de um e de outro átomo, independentemente do nº de electrões que contenham (0, 1 ou 2) Combinam-se apenas as orbitais da camada de valência contendo 1 electrão (uma de cada átomo) Todas as OA de um átomo combinamse, em princípio com todas as OA para originar OM. A combinação de OA duas a duas é uma simplificação As orbitais só se combinam 2 a 2 (uma de cada átomo) Todos os electrões da molécula estão em OM (mesmo quando elas têm características muito semelhantes às que tinham nos átomos isolados) orbitais não ligantes Todos os electrões as camadas internas e os da camada de valência que estão em orbitais completamente preenchidas permanecem em OA Há orbitais Ligantes, não Ligantes e anti Ligantes, ou seja há electrões Ligantes, não Ligantes e anti Ligantes Só há electrões ligantes não ligantes e atómicos (que podemos designar de não ligantes para efeitos de analogia) GRUPOS FUNCIONAIS Alcanos, Alcenos e Alcinos Álcool, Éter, Aldeído, Cetona, Ácido Carboxílico, Éster, Amina e Amida sp2 N Hidrocarbonetos - Alcanos 1. Hibridação sp3 2. Ângulos ≅ 109º 28´ Metano 3. µ = 0 4. Moléculas Apolares Etano Propano Hibridação sp3 Todos os átomos de carbono com Hibridação sp3 Butano Hidrocarbonetos - Alcanos Metano Hidrocarbonetos - Alcanos Hidrocarbonetos - Alcenos Eteno Propeno Hibridação sp2 Ângulos = 120º Hibridação sp3 Ângulos ≅ 109º 28´ 1-Buteno Fracções de Petróleo Fracções de Petróleo Faixa de Ebulição (ºC) abaixo de 20 40 – 200 175 – 325 250 – 400 350 - 500 A auto-ignição pode ser evitada pelo uso de gasolina com elevado índice de octanas Hidrocarbonetos - Alcinos Etino Hibridação sp Ângulos = 180º Propino Hibridação sp3 Ângulos ≅ 109º 28´ 1-Butino Hibridação sp ↑↓ 2s ↑↓ 2s ↑ ↑ 2p ↑ ↑ ↑ 2p hibridação sp C 2σ σ 2π π ↑ ↑ 2sp N 1σ 2π ↑ ↑ 2p ↑ Átomo não hibridado ↑ ↑ 2sp ↑ ↑ 2p HC≡N ↑ pC ↑ ↑ 2π σ ↑ ↑ pN ↑ ↑↓ sp N σ 1s H • Hibridação sp – Geometria linear – Ângulo de ligação 180° • Os átomos usam as orbitais p (não hibridadas ou puras) para as ligações π ↑ sp C ↑ Hibridação sp H s C sp π σ π N sp Outros Grupos Funcionais Biological production of ethanol C6H12O6 (aq) enzyme 2CH3CH2OH (aq) + 2CO2 (g) Grupo Funcional – Álcool (-OH) Geometria do Metanol Commercial production of ethanol CH2 CH2 (g) + H2O (g) H2SO4 CH3CH2OH (g) Metabolic oxidation of ethanol CH3CH2OH alcohol dehydrogenase CH3CHO + H2 Hibridação sp3 (Geometria tetrahédrica) Grupo Funcional – Ácido Carboxílico (-COOH) Geometria da Glicina (aminoácido) Hibridação sp2 Hibridação sp3 Hibridação sp3 Polaridade (Convenção sinal) Molécula Apolar Aldeído (H2C=O) Geometria do Éter Etilico Geometria da Acetona CH3CH2-O-CH2CH3 CH3(C=O)CH3 Hibridação sp2 Todos os átomos com Hibridação sp3 Hibridação sp3 Geometria de Éster AROMAS ARTIFICIAIS Butanoato de etilo: éster responsável pelo aroma de abacaxi em refrescos artificiais. Hibridação sp2 O composto Metanoato de etilo confere o aroma artificial de groselha. Os ésteres de baixo peso molecular têm odores característicos dos frutos (usados como aromas sintéticos em bebidas). Butanoato de butilo é um composto com o aroma do ananás. Valerato de isoanilo tem o aroma da maçã. Antranilato de metilo: flavorizante que dá sabor artificial de uva nos refrescos Geometria de Amida Geometria de Amina Hibridação sp2 Exemplos de Aplicação Hibridação sp3 Hibridação sp3 Morfina (fármaco) Acetamida (indústria papel) Exemplo – Preveja a Hibridação de todos os átomos em H3BO3 •• •O • H •• O •• B H •• O •• H H = não sofre hibridação B = 3 grupos de electrões = sp2 O = 4 grupos de electrões = sp3 Exemplo – Preveja a Hibridação de todos os átomos em NClO •• •O • •• N •• Cl •• •• N = 3 grupos de electrões = sp2 O = 3 grupos de electrões = sp2 Cl = 4 grupos de electrões = sp3
Download