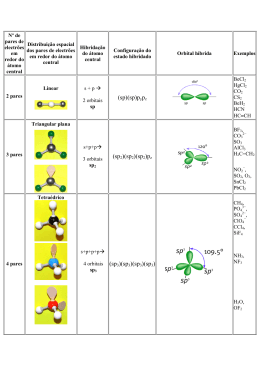
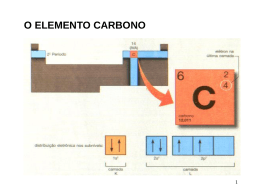
TEORIA DE LIGAÇÃO DE VALÊNCIA (T.L.V.) A formação das ligações se dá pela superposição dos orbitais atômicos. LIGAÇÃO SIMPLES – Apenas um par de elétrons é compartilhado entre os átomos. – Ligação σ: ocorre quando a região de superposição contem o eixo de ligação. 1) Interação de dois orbitais s. Ex. H2 2) Interação entre orbitais s e p. Ex. HCl 3) Interação entre 2 orbitais p frente a frente. Ex. Cl2 LIGAÇÕES MÚLTIPLAS • Ligações σ: a densidade eletrônica encontra-se no eixo entre os núcleos. • Todas as ligações simples são ligações σ. • Ligações π: a densidade eletrônica encontra-se acima e abaixo do plano dos núcleos. • Uma ligação dupla consiste de uma ligação σ e de uma ligação π. • Uma ligação tripla tem uma ligação σ e duas ligações π. • Normalmente, os orbitais p envolvidos nas ligações π vêm de orbitais não-hibridizados. EXEMPLO: etileno, C2H4 • Ligação dupla. • Uma ligação σ e uma ligação π. • Ambos os átomos de C apresentam hibridização sp2 e geometria trigonal plana. EXEMPLO: acetileno, C2H2 • Ligação tripla. • Uma ligação σ e duas ligações π: uma acima e abaixo e a outra à frente e atrás do plano dos núcleos. HIBRIDAÇÃO • Fusão de orbitais de subníveis diferentes, geralmente do mesmo nível energético. • Matematicamente, o processo envolve a combinação (adição algébrica) das funções de onda dos OA apropriados (CLOA). Orbitais híbridos sp • Os lóbulos dos orbitais híbridos sp estão a 180º de distância entre si. HIBRIDAÇÃO sp BeF2 Be: 1s22s2. Não existem elétrons desemparelhados disponíveis para ligações. Sabemos que : • o ângulo de ligação F-Be-F é de 180° • elétron de Be é compartilhado com elétron do F. Orbital 2s e um orbital 2p no Be se misturam (orbital híbrido sp): Be: EF EH __ 2s __ __ __ 2p __ __ __ __ sp 2p Elétron do F Orbitais sp Be F HIBRIDAÇÃO sp Geometria: linear Exemplos: BeF2, HgCl2 F Orbitais híbridos sp2 • Os orbitais híbridos sp2 são formados com um orbital s e dois orbitais p. • Os grandes lóbulos dos híbridos sp2 encontram-se em um plano trigonal. • Todas as moléculas com arranjos trigonais planos têm orbitais sp2 no átomo central. HIBRIDAÇÃO sp2 B: 1s22s22p1 BH3 Um orbital 2s e dois orbitais 2p no B se misturam (orbital híbrido sp2): B: EF __ __ __ __ 2s 2p EH __ __ __ __ sp2 2p Elétron do H HIBRIDAÇÃO sp2 Geometria: trigonal plana Exemplos: BF3, SO3 Orbitais híbridos sp3 • Os orbitais híbridos sp3 são formados a partir de um orbital s e três orbitais p. Há quatro lóbulos grandes. • Cada lóbulo aponta em direção ao vértice de um tetraedro. • O ângulo entre os grandes lóbulos é de 109,5°. • Todas as moléculas com arranjos tetraédricos são hibridizadas sp3. HIBRIDAÇÃO sp3 C: 1s22s22p2 CH4 Um orbital 2s e três orbitais 2p no C se misturam (orbital híbrido sp3): C: EF __ __ __ __ 2s 2p EH __ __ __ __ sp3 Elétron do H HIBRIDAÇÃO sp3 Geometria: tetraédrica Exemplos: CH4, NH3, H2O HIBRIDAÇÃO sp3 N: 1s22s22p3 NH3 N: EF __ 2s __ __ __ 2p EH __ __ __ __ Elétron do H sp3 .. N H H H Pirâmide Trigonal HIBRIDAÇÃO sp3 O: 1s22s22p4 H2O O: EF __ 2s __ __ __ 2p EH __ __ __ __ Elétron do H sp3 ..O.. H H Angular Hibridização envolvendo orbitais d • Os arranjos de bipirâmide trigonais necessitam de hibridização sp3d. • Os arranjos octaédricos requerem hibridização sp3d2. HIBRIDAÇÃO sp3d PCl5 P: 1s22s22p63s23p3 Um orbital 3s, três orbitais 3p e um orbital d no P se misturam (orbital híbrido sp3d): P: EF EH __ __ __ __ 3s 3p __ __ __ __ __ 3d __ __ __ __ __ __ __ __ __ sp3d 3d Elétron do Cl HIBRIDAÇÃO sp3d Geometria: bipiramidal trigonal Exemplos: PF5, SF4, BrF3 SF2Cl2 S: EF EH HIBRIDAÇÃO sp3d S: 1s22s22p63s23p4 __ __ __ __ 3s 3p __ __ __ __ __ 3d __ __ __ __ __ __ __ __ __ sp3d Elétron do F e Cl 3d gangorra [ICl2]I: EF EH HIBRIDAÇÃO sp3d I: ….5s25p5 __ __ __ __ 5s 5p __ __ __ __ __ 5d __ __ __ __ __ __ __ __ __ sp3d Elétron do Cl e carga negativa 5d linlinear ICl3 I: EF EH HIBRIDAÇÃO sp3d I: ….5s25p5 __ __ __ __ 5s 5p __ __ __ __ __ 5d __ __ __ __ __ __ __ __ __ sp3d Elétron do Cl 5d em “T” HIBRIDAÇÃO sp3d2 SF6 S: EF EH S: 1s22s22p63s23p4 __ __ __ __ 3s 3p __ __ __ __ __ 3d __ __ __ __ __ __ __ __ __ sp3d2 3d Elétron do F HIBRIDAÇÃO sp3d2 Geometria: octaédrica Exemplos: SF6, ClF5, XeF4, PF6- IF5 I: EF EH HIBRIDAÇÃO sp3d2 I: ….5s25p5 __ __ __ __ 5s 5p __ __ __ __ __ 5d __ __ __ __ __ __ __ __ __ sp3d2 5d Pirâmide tetragonal Elétron do F XeF4 Xe: EF EH HIBRIDAÇÃO sp3d2 Xe: ….5s25p6 __ __ __ __ 5s 5p __ __ __ __ __ 5d __ __ __ __ __ __ __ __ __ sp3d2 5d Quadrado Planar Elétron do F BIBLIOGRAFIA • Barros, H. L.C. Química Inorgânica – Uma Introdução, Editora UFMG, 1992. • Brown, T. L.; LeMay Jr., H. E.; Bursten, B. E.; Burdge, J. R. Química – A Ciência Central, 9ª Ed., Pearson Education Inc. 2003. • Russell, J.D. Química Geral, 2ª ed. Editora McGraw Hill Ltda. Vol 1 e 2, 1994.
Download