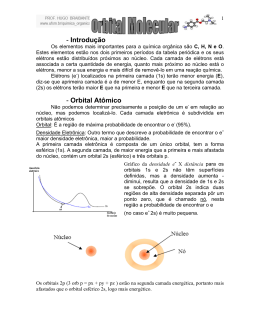
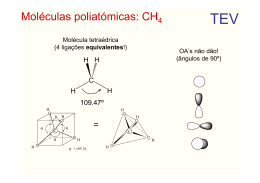
Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo Ligação Química e Estudo do Átomo de Carbono Aula 1 1- INTRODUÇÃO Os átomos são formados por nêutrons, prótons e elétrons. Prótons (carga positiva) + Nêutrons (sem carga) = constituem o núcleo e são virtualmente responsáveis pela massa atômica. Os elétrons são carregados negativamente e encontram-se circulando o núcleo em órbitas definidas. Cada átomo contém o mesmo número de prótons e elétrons e, por conseqüência, é eletricamente neutro. A massa do elétron é desprezível, comparada às massas dos prótons e nêutrons. O volume ocupado pelo elétron, chamado de eletrosfera, é extremamente maior que o tomado pelo núcleo. Por exemplo, se todo o volume ocupado pelos elétrons em uma moeda de 5,5 g de níquel fosse ocupado por prótons e neutrons , ela pesaria aproximadamente 100 milhões de toneladas. Uma vez que os elétrons são responsáveis por praticamente o volume dos átomos, eles têm um papel predominante sobre as propriedades químicas e físicas dos elementos e compostos. 2- ORBITAIS ATÔMICOS O orbital é a região do espaço onde é mais provável encontrar um elétron Os orbitais atômicos são designados pelas letras s, p, d e f. O orbital s é esférico. O orbital p tem forma de alteres distribuídos sobre os três eixos cartesianos: Os orbitais atômicos se localizam sobre diversos níveis de energia ou camadas, que são designados por números (1 a 7). 3- LIGAÇÕES QUÍMICAS Os átomos, apesar da neutralidade elétrica, são espécies instáveis e reativas. Eles tendem a se combinar, de modo que a sua camada de valência 3.1- Ligação iônica A ligação iônica envolve a completa transferência de elétrons entre espécies com eletronegatividades distintas. Exemplos: NaCl, MgCl2. Na tabela periódica a eletronegatividade cresce da esquerda para a direita e decresce de cima para baixo. Li Be B C N O F 1,0 1,5 2,0 2,5 3,0 3,5 4,0 Aumenta 4,0 F 3,0 Cl 2,8 Br Um exemplo do fenômeno da ligação iônica é mostrado a seguir, ilustrando a molécula de fluoreto de lítio. _ + Li + F Li + F Neste caso, a ligação está sendo formada entre o elemento mais eletropositivo, o Li, e o mais eletronegativo, o F. A perda de um elétron do lítio, leva a formação da espécie iônica Li+ e com isso o flúor ganha um elétron formando a espécie iônica F-. 3.2- LIGAÇÃO COVALENTE A ligação covalente ocorre com elementos que apresentam a mesma ou similar eletronegatividade e envolve o compartilhamento entre. H + H H..H + 435kJ/mol Outros exemplos: Cl2, CH4 , NH3, CCl4, H2O Em todos esses casos, as espécies envolvidas possuem 8 elétrons no último nível ocupado. Cl – 7 elétrons no último nível – compartilha somente 1 elétron. O – 6 elétrons no último nível – compartilha dois elétrons. N – 5 elétrons no último nível – compartilha 3 elétrons. O par de elétrons compartilhado é representado por um traço, por isso as substâncias acima são representadas da seguinte forma H Cl Cl C Cl Cl H N H 4- O ÁTOMO DE CARBONO O carbono, um dos elementos mais abundantes na natureza, pertence ao Grupo IV A e possui número atômico 6 e peso atômico 12,011. Distribuição eletrônica do C : 5- HIBRIDIZAÇÃO No carbono, a hibridização significa a “mistura” entre orbital s e orbitais p. Como, no estado excitado do carbono, temos 1 orbital s e três orbitais p que podem hibridizar-se. 5.1- Hibridização sp3 - Nesta hibridação ocorre a “mistura” do orbital s com os tres orbitais p, resultando em quatro orbitais híbridos sp3. Entre os três orbitais híbridos teremos um ângulo de 109,5º. Ex. Formação do metano Potencial eletrostático do etano 5.2- Hibridação sp2 - Nesta hibridação ocorre a “mistura” do orbital s com os dois orbitais p, resultando em três orbitais híbridos sp2 e um orbital p . Entre os três orbitais híbridos teremos um ângulo de 120º e estes em relação ao orbital p um ângulo de 90º. Exemplo: Formação da molécula do eteno Potencial eletrostático do eteno 5.3-Hibridação sp - Nesta hibridação ocorre a “mistura” do orbital s com um orbital p, resultando em dois orbitais híbridos sp e dois orbitais p . Entre os dois orbitais híbridos teremos um ângulo de 180º e estes com relação a cada orbital p um ângulo de 90º. Exemplo: Formação do etino Potencial eletrostático do eteno 6- PROPRIEDADES DO C, EM FUNÇÃO DO TIPO DE HIBRIDIZAÇÃO Como em cada tipo de carbono híbrido o percentual de caráter s difere, teremos diferenças significativas nas suas propriedades. sp3 25 % de caráter s e 75 % de caráter p sp2 33,3 % de caráter s e 66,6 % de caráter p sp 50 % de caráter s e 50 % de caráter p Como o orbital s está mais próximo do núcleo em relação ao orbital p, concluímos que quanto maior o percentual de caráter s presente no carbono híbrido, maior a sua eletronegatividade: sp3 < sp2 < sp 7- EFEITOS DA DIFERENÇA DE ELETRONEGATIVIDADE 7.1- Na ligação O efeito da diferença de eletronegatividade entre os carbonos com hibridação sp3, sp2 e sp é percebido no comprimento de ligação, pois, quanto maior a eletronegatividade, menor é o comprimento de ligação, inclusive na ligação C – H. C sp3 – C sp3 = 1,54 Aº C sp3 – H = 1,10 Aº C sp2 – C sp2 =1,34 Aº C sp2 – H = 1,09 Aº C sp – C sp =1,20 Aº C sp – H = 1,06 Aº 7.2- Na geometria molecular 6.3- Nas propriedades físicas O ponto de ebulição aumenta na ordem: C sp3 (alcanos) ; C sp2 (alquenos) ; C sp (alquinos)
Download