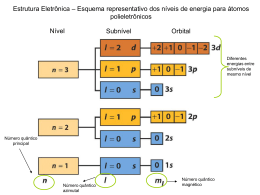
Átomos, moléculas e da Tabela Periódica. Descrição: Construindo um Composto usando camadas de eletrons Questão 1: Um elemento (X) tem a configuração eletrônica 1s22s22p63s23p3. Qual é a fórmula do composto mais provável que este elemento irá formar com Ca? Ca2X3 CaX2 Ca3X2 CaX Ca2X Descrição: Configuração de elétrons do estado fundamental Questão 2: Qual é a configuração de elétrons do estado fundamental para Fe3+? (Ar)183d5 (Ar)183d34s2 (Ar)183d44s (Ar)183d64s2 (Ar)183d6 Descrição: Princípio da Exclusão de Pauli Questão 3: A Exclusão de Pauli princípio exige que: A velocidade de toda a radiação eletromagnética é igual à velocidade da luz. Não há dois elétrons no mesmo átomo pode ter o mesmo conjunto de quatro números quânticosn, l, ml,e ms. Uma partícula de massa m, movendo-se com uma velocidade v, tem um comprimento de onda λ=hmv. Eletrons degenerado em orbitais atômicos têm spin paralelo. Se a posição de um Eletro for conhecido com exatidão, a sua velocidade pode não ser simultaneamente conhecido com precisão. Descrição: Solubilidade dos sais da água Questão 4: Qual dos seguintes sais não é solúvel em água? SrCl2 Rb2SO4 NaIO3 K2CO3 BaCO3 Descrição: Compostos com cores Questão 5: Qual dos seguintes compostos que você esperaria ter cor (não branca)? Cu(NO3)2 Sc2O3 CdCl2 HgS RhF3 SrO PdBr2 AlCl3 RaBr2 Tl2S Descrição: Elétrons desemparelhados na configuração de elétrons do Estado terroso Questão 6: Os elementos que estão no quarto período da tabela periódica. Ca, V, Co, Zn, As Dos listados, os que têm elétrons desemparelhados na configuração de eletrons do estado fundamental são: Zn, Ca, e As V, Co, e As Ca, V, e Co V, Co, e Zn Ca, Zn, e As Descrição: Preenchendo 3d Shell Questão 7: Qual dos seguintes é o átomo com o menor número atômico que preenche totalmente 3d shell? Cu Ar Zn Cr Kr Descrição: Denominações do Estado Quântico Questão 8: n=3, l=2, ml=−2 II n=3, l=0, ml=−1 III n=3, l=1, ml=& ;0 IV n=3, l=3, ml=−2 V n=3, l=2, ml=& ;0 I Das designações estado quântico listados acima, que não descreve um estado permitido para um elétro em um átomo? II e V I e II III e IV II e IV IeV Descrição: Nomes dos Ácidos Questão 9: Combine os seguintes diagramas de Lewis para o nome correto, selecionando o nome correspondente às letras abaixo. A: B: C: A D: B C D Tipos de Descrição: ligações em compostos Questão 10: Selecione uma das seguintes moléculas que se encaixa na descrição. A: CS2 B: RaCl2 C: HCN D: F2 E: C2Cl4 (a) tem apenas uma ligação pi. (b) tem duas ligações duplas. (c) tem uma ligação tripla. (d) exibe ligação iónica. (e) consiste de moléculas polares, discretas, à temperatura ambiente. (f) tem uma ligação simples apolar. (g) é uma temperatura ambiente de um sólido. Descrição: Estrutura de Lewis Questão 11: Na melhor estrutura de Lewis para ICI3 , qual é a carga na forma em I? +2 −1 0 −2 +1 Descrição: Ligações Polares Questão 12: Qual dos seguintes não é polar, mas contém ligações polares? H2O HCl SO2 SO3 NO2 Descrição: estrutura geométrica Questão 13: Qual é a estrutura geométrica da molécula trigonal bipiramidal quadrado plano tetraédrico trigonal plano piramidal trigonal PF3? Descrição: Formar ligações com híbridos orbitais atômicos Questão 14: Em qual uma das seguintes moléculas faz o uso átomo central formação de ligações? sp2 orbitais atômicos híbridos na H2S NH3 SO2 Cl2O CS2 Descrição: Imagens de orbitais híbridos Questão 15: Indique o nome de cada um dos orbitais híbridos comumente utilizados abaixo. Descrição: Determine as Séries Questão 16: Se o eletro em um hidrogênio atômico vai do n=6 para o n=1 em nível de energia , a radiação emitida em cada séria de linha no espectro de um hidrogênio atômico? Lyman Balmer Pfund Brackett Paschen Descrição: Energia necessária para remover o Eletro do seu estado fundamental Questão 17: A quantidade de energia necessária para remover o eletro de um Be3+ ion no seu estado fundamental é o número de vezes maior do que a quantidade de energia necessária para remover o eletro de um H átomo em seu estado fundamental? [No.] Descrição: Segunda Linha mais intensa na Série Lyman Questão 18: Click on the image and select the highlighted arrow that represents the second most intense line in the "Lyman Series" for a given electron. Note: There are 5 choices. Descrição: Números quânticos em Séries Questão 19: Quais são os valores de nH e nLpara a linha fourth nas series Brackett no especto de hidrogénio atómico? nL = [No.] nH = [No.] Descrição: Propriedades da Onda Questão 20: Qual das seguintes propriedades de onda é proporcional à energia para a radiação eletromagnética? Velocidade Numero de Onda Amplitude Comprimento da Onda Período Descrição: Magnitude de energia liberada entre níveis de energia Questão 21: É liberada a energia entre os níveis de energia com n=3 e n=4 do que a energia liberada entre os níveis de energia com n=8 e n=9, para o átomo de hidrogénio. Digite a sua resposta com duas casas decimais. [No.] vezes maior Descrição: Nomeando Compostos Inorgânico Questão 22: Combine cada um dos itens numerados na lista com os números nos menus : iron(I II) hydro xide 1. 2. 3. 4. 5. 6. 7. KHSO3 Fe(OH)2 Cu2CO3 Fe(OH)3 CrO CuCO3 (NH4)2C2O4 potass ium hydro gen sulfat e coppe r(I) carbo nate coppe r(II) carbo nate ammo nium oxalat e iron(I I) hydro xide chromiu m(II) oxide Descrição: Nome da Fórmula Dada Questão 23: Escolha a fórmula correta para o estanho (II) de sulfato. SnSO3 TiS SnS TiS2 SrSO3 Descrição: As soluções que conduzem eletricidade Questão 24: Uma solução aquosa do que um dos seguintes compostos não irá conduzir eletricidade? Ba(OH)2 CH3OH SrBr2 Ca(NO3)2 AgClO4 Descrição: Mais pobre condutor elétrico Questão 25: No estado líquido, qual das seguintes é a mais pobre condutor elétrico? NaI CBr4 SrSO3 SrBr2 KCN Descrição: Classifique compostos como Iônicos ou Molecular Questão 26: Classificar cada composto como iônico ou molecular. Rb2S= H2Se= NH3= CCl4= BaI2= OF2= BrF5= SrS= CO= Descrição: Metais de transição Questão 27: Selecione cada elemento que é um metal de transição. Gd Pt Rb Zn P Sr Ag Mg Hg U Li Th Mo Al Fe Cu Sb Mn
Download