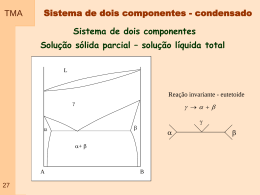
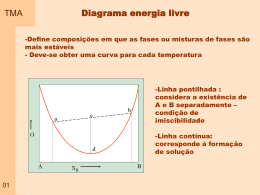
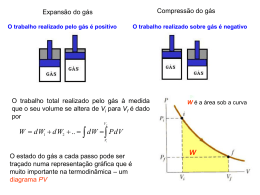
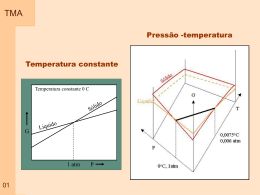
TMA 00a Ementa 1 – Conceitos básicos 2 – Comportamento de gases 3 – As leis da termodinâmica 3.1 – A primeira lei da termodinâmica 3.2 – A segunda lei da termodinâmica 3.3 – Representação matemática da primeira e da segunda lei 3.4 – Relações matemáticas entre a primeira e a segunda lei 4 – Termodinâmica e as reações químicas 5 – Equilíbrio 6 – Compostos Simples 7 – Soluções 8 – Diagrama de equilíbrio 8.1 - regra das fases 8.2 - Diagramas de equilíbrio binário 8.3 - Diagramas de equilíbrio ternário 9 – Diagrama de Ellingham TMA Material Didático Livro Texto Principal 00b TMA Material Didático Textos específicos em – Termodinâmica em materiais MUSGRAVE, Charles B., Thermodynamics and Materials Science ; Departments of chemical engineering and materials science and engineering. http://chemeng.stanford.edu/html/course_notes.html GASKELL, David R.; Introduction to metallurgical thermodynamics. Mc Graw-hill book company. New York, 1981, 610p. RAGONE, D.V.; Thermodynamics of materials Vol I. John Wiley & Sons, New York, 1995, 309. RAGONE, D.V.; Thermodynamics of materials Vol II. John Wiley & Sons, New York, 1995, 309. 00c ADAMIAN, Rupen, ALMENDRA, Ericksson. FísicoQuímica, Uma aplicação aos materiais. Rio de Janeiro, 2002, 606p. TMA Material Didático Textos em Termodinâmica química ou Físico-Química ATKINS, P.W.; Fisico-Química Vol 1. Editora LTC, Rio de Janeiro, 1999, 251. SMITH, J.M.; Introdução à termodinâmica da Engenharia Química. Editora LTC, Rio de Janeiro, 2000, 697 Textos – Diagramas de equilíbrio SEGADÃES, Ana Maria; Diagramas de fases, Teoria e aplicação em cerâmica. Editora Edgard blucher LTDA. São Paulo, 1987, 184p. BERGERON, Clifton G.; Introduction to phase equilibria in ceramics. The American Ceramic Society Inc., Columbus, Ohio, 1984,156p. 00d TMA Termodinâmica é conhecida desde a Antigüidade Estudo formal começou no século XIX, motivado pela utilização do CALOR como força motriz. Atualmente espectro bastante abrangente como ciência da ENERGIA relações entre as PROPRIEDADES da matéria. Na Física - interesse em compreender os fundamentos dos comportamentos Físico e Químico da matéria Na Engenharia - interesse em estudar sistemas e suas relações com a vizinhança 01 Britânicos inventam ovo cozido "auto-cronometrado" TMA O que é termodinâmica? A Termodinâmica está associada ao estudo de formas de energia e como esta pode ser convertida em outras formas de energia e trabalho. Termodinâmica clássica: Tem seus conceitos focalizados na análise de propriedades macroscópicas do sistema e o estudo da relação entre estas propriedades. Baseia-se no estudo de fenômenos e na determinação empírica das relações de interesse. – SISTEMA TRATADO COMO CONTÍNUO A termodinâmica clássica fornece as ferramentas físicas e matemáticas para determinar como as propriedades de um material serão alteradas em função de alterações do sistema. 02 TMA O que é termodinâmica? Termodinâmica estatística: Utiliza como ferramenta a descrição estatística do comportamento do sistema a parir do comportamento de cada átomo do sistema, individualmente. A termodinâmica estatística parte do princípio que conhecendo o comportamento do material a nível microscópico é possível prever suas propriedades macroscópicas. 02 TMA O que é termodinâmica? Termodinâmica clássica X Termodinâmica estatística Para a grande maioria das aplicações em engenharia, a TERMODINÂMICA CLÁSSICA não somente propicia uma abordagem mais direta para análise e projeto mas também requer menos complicações matemáticas. 03 Termodinâmica – Energia - Materiais TMA Comprimento de ligação Energia de Ligação Energia (E) F F r Comprimento de ligação ro r 04 Eo Energia de ligação TMA 05 TMA Termodinâmica – Energia - Materiais Formação de defeitos 06 TMA Termodinâmica – Temperatura - Materiais Transformação de fase Diagrama de Equilíbrio 07 TMA Termodinâmica – Temperatura - Materiais Diagrama de Equlíbrio 08 TMA SHS 09 TMA Cientistas estudam as efervescentes cócegas no nariz provocadas pelas emanações aromáticas, característica excitante e inconfundível do seu encanto A QUÍMICA QUE ESTRUTURA AS BOLHAS DO CHAMPANHE 10 TMA No CHAMPANHE e nas cervejas, o dióxido de carbono ( CO2 ) é o principal responsável pela formação de bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e CO2. A carbonatação industrial é a fonte da fermentação nas bebidas gasosas. Após o engarrafamento, estabelece-se um equilíbrio, de acordo com lei de Henry, entre o CO2 dissolvido no líquido e o gás que lei dea Henry está no espaço sob a rolha ou a tampa. A lei afirma que a quantidade de gás dissolvida em um fluido é proporcional à pressão do gás com o qual está em equilíbrio. Equilíbrio 11 Quando o recipiente é aberto, a pressão do CO2 gasoso sobre o equilíbrio líquido caitermodinâmico abruptamente, rompendo o equilíbrio termodinâmico até então prevalecente. Como resultado, o líquido é supersaturado com moléculas de CO2. TMA Para recuperar uma estabilidade termodinâmica correspondente à pressão atmosférica, estabilidade as moléculas de CO2 devem abandonar o termodinâmica fluido supersaturado. Quando a bebida é vertida em um copo, dois mecanismos permitem que o CO2 dissolvido escape: a difusão do líquido através da superfície livre e a formação de bolhas. Mas, para que se agrupem em bolhas embrionárias, as moléculas dissolvidas de dióxido de carbono são forçadas a abrir caminho através das moléculas líquidas agregadas, que estão fortemente ligadas pelas forças de van der Waals (atração bipolar). barreira de energia; Assim, a formação de bolhas é limitada por esta barreira de energia; para superá-la são necessárias taxas de supersaturação mais elevadas que as de bebidas carbonatadas. 12 TMA Em líquidos fracamente supersaturados, incluindo champanhe, vinhos espumantes, cervejas e sodas, a formação de bolhas , exige raios de curvatura cavidades de gás preexistentes com raios de curvatura extensa o barreira de nucleação de energia suficiente para superar a barreira de nucleação de energia e curvatura desenvolver-se livremente. interface Isto se dá porque a curvatura da interface da bolha acarreta um excesso de pressão no interior da bolsa de gás que é inversamente proporcional ao seu raio (de acordo com a lei de Laplace) .Quanto menor a bolha, maior o excesso 13 TMA Resumo de termodinâmica As leis da termodinâmica: Fornecem as regras básicas que governam as relações entre variáveis de um sistema. De uma forma geral, são as restrições que a natureza impõe ao processo de transformação de energia. Definições termodinâmicas: São definidos parâmetros como capacidade calorífica, compressibilidade, coeficiente de expansão térmica, entalpia, energia livre de Helmoltz e energia livre de Gibbs. Variáveis termodinâmicas: O estado de um sistema é definido em função dos valores de algumas propriedades, ou variáveis do sistema. As diferentes variáveis que podem ser usadas para descrever este estado incluem energia, entropia, composição química, temperatura, pressão e volume. 14 TMA 15 TMA Resumo de termodinâmica Funções de estado: Está associado com variáveis onde o processo depende apenas das condições iniciais e finais, e independe da história do sistema. Relações matemáticas: Existem quatro relações que podem ser determinadas a partir de funções de estado. Estas relações são denominadas por relações de Maxwell. Condições de equilíbrio: Um sistema está em equilíbrio quando todas as suas propriedades são independentes do tempo e são função apenas de suas variáveis de estado. Deve-se tomar cuidado com esta definição já que em algumas situações a variação de uma propriedade com o tempo é muito lenta, podendo ser confundido com uma condição de equilíbrio. 16 Definições - Sistema TMA Sistema : Refere-se à região macroscópica do universo definida e selecionada para análise. Pode ser de qualquer tamanho, podendo até ser considerado todo o universo como um sistema. FRONTEIRA VIZINHANÇA SISTEMA 17 TMA Definições – Tipos de Sistemas Aberto : É aquele em que existe troca de energia e troca de massa entre sistema e vizinhança Fechado: É aquele em que existe troca de energia mas não existe troca de massa. Isolado: Sistemas onde não troca de material ou energia. 18 ocorre TMA Definições – Tipos de Sistemas Sistemas puros ou compostos: Sistemas puros são aqueles constituídos por uma substância. Esta substância pode ser um elemento atômico (Silício) ou uma molécula (água pura). Multicomponentes apresentam várias substâncias. Homogêneo ou Heterogêneo: Um sistema homogêneo tem uma única fase. Um sistema heterogêneo apresenta várias fases. Reativo ou não reativo: sistemas reativos formação ou dissociação de ligações químicas. envolvem a Simples ou complexo: Um sistema simples é aquele que não é influenciado por energias diferentes da energia mecânica, química ou térmica. 18 Definições - Sistema TMA Sistema : FRONTEIRA VIZINHANÇA SISTEMA SISTEMA FECHADO = SISTEMA = MASSA DE CONTROLE VOLUME DE CONTROLE = SISTEMA ABERTO FRONTEIRA = SUPERFÍCIE DE CONTROLE 19 TMA Definições – Função de estado Funções de estado: São variáveis ou propriedades de um sistema que são independentes da história do sistema, dependendo apenas do estado inicial e final do sistema. As funções de estado não dependem do processo pelo qual o sistema foi levado a este estado. EXEMPLO - Temperatura A B 20 TMA Definições – Função de estado (outra definição) Características MACROSCÓPICAS de um sistema, como MASSA, VOLUME, ENERGIA, PRESSÃO E TEMPERATURA, que não dependem da história do sistema. Uma determinada quantidade (massa, volume, temperatura, etc.), é uma PROPRIEDADE, se, e somente se, a mudança de seu valor entre dois estados é independente do processo. A B 21 TMA Definições – Estado Condição do sistema, como descrito por suas propriedades. Como normalmente existem relações entre as propriedades, o ESTADO pode ser caracterizado por um subconjunto de propriedades. Todas as outras propriedades podem ser determinadas em termos desse subconjunto. PROCESSO: Mudança de estado devido a mudança de uma ou mais propriedades. ESTADO ESTACIONÁRIO: Nenhuma propriedade muda com o tempo. CICLO TERMODINÂMICO: Seqüência de processos que começam e terminam em um mesmo estado. Exemplo: vapor circulando num ciclo de potência. 22 TMA Definições – Variável de sistema Variáveis do sistema: Ao contrário das funções de estado, as variáveis do sistema são definidas apenas quando o processo que foi seguido para ir do estado A ao estado B é conhecido. Assim, a variável de processo é a variável que não é definida para estados de um sistema e tem sentido apenas quando se fala no movimento de um estado para outro. EXEMPLO - calor (Q) e o trabalho (W). Q1 Q3 A 23 Q2 W1 W3 W2 B TMA Definições – Propriedade intensiva x extensiva Propriedades intensivas: são aquelas que não dependem do tamanho do sistema e podem ser especificadas para qualquer ponto do sistema. Não são aditivas Seus valores não dependem do tamanho e extensão do sistema. Podem variar de um lugar para outro dentro do sistema em qualquer momento. Exemplo: temperatura e pressão. Propriedades extensivas: são aquelas que não podem ser especificadas para um ponto particular e dependem do tamanho do sistema. Seu valor para o sistema inteiro é a soma dos valores das partes em que o sistema for subdividido. Dependem do tamanho e extensão do sistema. Seus valores podem variar com o tempo. Exemplo: massa, energia, volume. 24 TMA Quantidade Quantidade molar (Xm)- Propriedade extensiva (X) de uma substância dividido pela quantidade de matéria presente (n) EXEMPLO: volume molar, massa molar Quantidade parcial molar (Xi)- Propriedade extensiva (X) de um sistema composto, em função da variação da quantidade de uma substância A presente. EXEMPLO: O volume parcial molar de uma substância A em uma mistura é a variação do volume da mistura provocada pela variação da quantidade do componente A (vA) 25 Fase e Substância Pura TMA FASE Quantidade de matéria que é homogênea tanto em composição química quanto em estrutura física. Homogeneidade na estrutura física significa que a matéria é totalmente sólida, totalmente líquida ou totalmente gasosa. Um sistema pode conter uma ou mais fases. Exemplo: água e seu vapor. Notar que os gases e alguns líquidos podem ser misturados em qualquer proporção para formar uma única fase. SUBSTÂNCIA PURA É invariável em composição química e é uniforme. Pode existir em mais de uma fase desde que seja garantida a condição acima. 26 TMA Método para resolver um problema Os primeiros passos em uma análise termodinâmica são: 1 - Definição do sistema; 2 - Identificação das interações relevantes com a vizinhança. 3 - Estabelecer: O que é conhecido: resumir o problema em poucas palavras; O que é procurado: resumir o que é procurado; 4 - Esquema e dados: Definir o sistema; identificar a fronteira; Anotar dados e informações relevantes; Hipóteses; Análise: feita sobre as equações (conservação da massa, conservação da energia, segunda lei da termodinâmica); Comentários: interpretar. 27 TMA Unidades Tabela 1.1. Comparação SI e Sistema Inglês Comprimento: 1 ft = 12 in (polegadas) = 0,3048 m Massa: 1 lbm = 0,45359237 kg Força : F= ma 1 N = 1 (kg) x 1 (m/s2) 1 lbf = 1 (lbm) x 32,174 (ft/s2) Tabela 1.4. SI Unidades - Prefixos 1 lbf = 4,448215 N 28 TMA Unidades Tabela 1.5. Fatores de Conversão entre unidades SI e do Sistema Inglês 29
Download