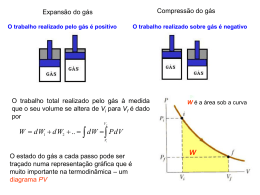
TERMODINÂNICA 1ª e 2a Leis Termodinâmica é a ciência que trata • do calor e do trabalho • das características dos sistemas e • das propriedades dos fluidos termodinâmicos Alguns ilustres pesquisadores que construiram a termodinâmica James Joule 1818 - 1889 Sadi Carnot 1796 - 1832 Emile Claupeyron 1799 - 1864 Wiliam Thomson Lord Kelvin 1824 - 1907 Rudolf Clausius 1822 - 1888 Contribuição de James Joule. 1839 Experimentos: trabalho mecânico, eletricidade e calor. James P. Joule (1818-1889) Nasceu em Salford - Inglaterra 1840 Efeito Joule : Pot = RI2 1843 Equivalente mecânico do calor ( 1 cal = 4,18 J) 1852 Efeito Joule-Thomson : decrescimo Lei da Conservação de Energia da temperatura de um gás em função da expansão sem realização de trabalho externo. As contribuições de Joule e outros levaram ao surgimento de uma nova disciplina: a Termodinâmica 1a Lei da Termodinâmica Para entender melhor a 1a Lei de Termodinâmica é preciso compreender as características dos sistemas termodinâmicos e os caminhos “percorridos” pelo calor... Sistema Termodinâmico Certa massa delimitada por uma fronteira. Sistema fechado Vizinhança do sistema. O que fica fora da fronteira Sistema que não troca massa com a vizinhança, mas permite passagem de calor e trabalho por sua fronteira. Sistema isolado Sistema que não troca energia nem massa com a sua vizinhança. Transformação Variáveis de estado Variáveis de estado P1 V1 T1 U1 P2 V2 T2 U2 Estado 1 Transformação Estado 2 Processos “Caminho” descrito pelo sistema na transformação . P1 V1 T1 U1 Processos P2 V2 T2 U2 Durante a transformação Isotérmico temperatura invariável Isobárico Pressão invariável Isovolumétrico volume constante Adiabático É nula a troca de calor com a vizinhança. Transformações 1a Lei da Termodinâmica Sistema Fechado W = δ > 0 → energia que sai do sistema W = δ < 0 → energia que entra no sistema Q > 0 → calor que entra no sistema Q < 0 → calor que sai do sistema ΔU = U2 – U1 1a Lei Variação Energia Interna Q = δ + ΔU Balanço Energético Gás Gás Recebe calor Q>0 cede calor Q<0 Não troca calor Q=0 Realiza trabalho >0 ΔV > 0 Recebe trabalho <0 ΔV < 0 Não realiza, nem recebe trabalho =0 Aumenta a energia interna Gás (Transformação adiabática, = - ΔU) Diminui a energia interna Não varia a energia interna (volume constante,transformação isométrica, Q = ΔU) ΔU > 0 ΔU < 0 ΔU = 0 ΔT = 0 ΔT > 0 ΔT < 0 (temperatura constante, transformação isotérmica, Q = ) Variação da Energia Interna ∆U = Q - δ Gás Expansão nula δ=0 ∆U = Q Δ U = Q = (mc)gás ΔT ΔT = 0 → ΔU = 0 ΔT > 0 → ΔU > 0 ΔT < 0 → ΔU < 0 Como (mc)gás = ctc ΔU depende apenas de ΔT. Como U é uma variável de estado, ΔU não depende do processo. A energia interna de um gás é função apenas da temperatura absoluta T. O calor Q que passa pelas fronteiras do sistema depende do processo. O trabalho que atravessa a fronteira depende do processo? Pr = Pressão ∆U = Q - δ δ = F.d d = deslocamento F = Pr.S δ = Pr.S.d ∆V = V2 -V1 δ = Pr.ΔV δ depende de como a pressão e volume mudam no processo. Diagramas P x V Gases ideais Estado 1 P1 Como as variáveis de estado se relacionam? 1 T1 V1 Equação de estado no de moles P1V1 = nRT1 Constante dos gases R = 8,31 J/mol.K = 2 cal/mol.K Processo isovolumétrico (Isocórico ou Isométrico) Transformação a volume constante Q = n CV (T2-T1) Calor específico molar a volume constante 1ª Lei da Termodinâmica Transformação de 1 → 2 U = Q - δ δ=0 U = Q ∆V = 0 Volume invariável Isovolumétrica U = Q = n CV (T2-T1) Processo isobárico Transformação a pressão constante calor específico molar a pressão constante Q = + n CP (TB - TA) δ = Po . (VB-VA) ∆U = n Cv (TB-TA) Calor específico a volume constante 1ª Lei da Termodinâmica U = Q - δ Processo Isotérmico Transformação à temperatura constante Êmbolo movimentado lentamente ∆U = 0 → ∆T=0 0 = Q–δ Q=δ Q = W = n R T [ln(V2/V1)] Processo adiabático Transformação sem troca de calor Movimento rápido do êmbolo. Q=0 Q=0 O processo ocorre tão rapidamente que o sistema não troca calor com o exterior. Primeira Lei da Termodinâmica ∆U = Q – δ Q = 0 → ∆U= - δ Compressão adiabática δ Área sob o grafico Trabalho transforma-se em calor Processos cíclicos 1.- ∆Uciclo = ∆U = 0 pois Tfinal = Tinicial 2.- Qciclo = Q 3.- ciclo = = área 12341 1a Lei da Termodinâmica ∆Uciclo = Qciclo - ciclo Qciclo = ciclo ciclo > 0 → Qciclo 0 O sentido do ciclo no diagrama PV : horário. O sistema recebe Q e entrega Máquinas Térmicas “Trabalham” em ciclos. A máquina de Denis Papin 1647 - 1712 Trabalho Para onde a máquina rejeita calor QCold Fonte quente Fonte fria De onde a máquina retira calor QHot. Ciclo Transformações máquinas térmicas - Diagrama PV Ciclo de Otto Ciclo Diesel Rendimento (Eficiência) térmica: 1ªLei Em cada ciclo U 0 Q1 Q2 (Q1 Q2 ) Q1 Q1 Q1 Q2 Q1 Q1 Q1 Q2 1 Q1 Ciclo Refrigerador Bomba de calor Refrigerador 12: compressão adiabática em um compressor 23: processo de rejeição de calor a pressão constante 34: estrangulamento em uma válvula de expansão (com a respectiva queda de pressão) 41: absorção de calor a pressão constante, no evaporador COP - Coeficiente de Performance Primeira Lei da Termodinâmica Em cada ciclo ∆U = 0 → + Q2 = Q1 = Q1 - Q2 Coeficiente de Performance – COP COP refrigerador = Q2/ = Q2/(Q1 - Q2 ) = T2/(T1 – T2) COP bomba calor = Q1/ = Q1/(Q1 - Q2 ) = T1/(T1-T2) Uma bomba de calor necessita de 1.000 W da rede para funcionar e aquece 1 litro de água de 0,5oC /s. Qual o COP desta bomba? 2a Lei da Termodinâmica 1a Lei da Termodinâmica 2a Lei da Termodinâmica A energia total do Universo, com ou sem transformações, permanece constante. A disponibilidade de energia para realização de trabalho diminui após cada transformação Refrigerador ou Bomba de Calor COPRefrigerador = Q2/δ COP Bomba Calor = Q1/ δ Segunda Lei Formulação de Clausius É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir um dispositivo que, operando em ciclo termodinâmico, não produza outros efeitos além da passagem de calor de um corpo frio para outro quente. Máquinas Térmicas = 2 – 1 η = /Q1 = [1 - T2/T1] < 1 2a LeiTermodinâmica Formulação de Kelvin-Planck É impossível construir uma máquina térmica com eficiência 100%. Ou seja uma máquina que retira uma quantidade de calor Q de uma fonte quente e a transforme totalmente em trabalho. Segunda Lei Termodinâmica Formulação de Clausius Formulação Kelvin-Planck É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir uma máquina térmica com eficiência 100%. Ambas são afirmações negativas. Não podem ser demonstradas. Baseiam-se em evidências experimentais. A 2a Lei enuncia a impossibilidade de construção de moto perpétuo de 2a espécie. Moto Perpétuo 1a Espécie: criaria trabalho do nada. Viola a 1a Lei. 2a Espécie: viola a 2a Lei 3a Espécie: inexistencia de atrito produziria movimento eterno sem realização de trabalho Qual o limite da eficiência de uma máquina térmica ? η = [1 – Q2/Q1] Q1 → 0 η→1 É possível construir esta máquina? η → 100% Máquinas Térmicas 100% de rendimento ? Impossível! Qual o máximo rendimento de uma Máquina Térmica? A construção de uma máquina ideal Definição de um processo ideal. Processo reversível. Aquele que tendo ocorrido, pode ser invertido de sentido e retornar ao estado original, sem deixar vestígios no sistema e no meio circundante. Processo reversível: desvio do equilíbrio é infinitesimal e ocorre numa velocidade infinitesimal. Causas que tornam um processo irreversível. Atrito Expansão não resistida. Mistura de 2 substâncias diferentes. Outros fatores: Efeito Joule, Combustão, Histerese, etc. Troca de calor com diferença finita de temperatura. O processo de troca de calor pode ser reversível se for feita mediante diferença infinitesimal de temperatura, mas que exige tempo infinito ou área infinita. Conclusão: todos os processos reais de troca de calor são irreversíveis. A máquina ideal de Carnot Ciclo reversível A eficiência da Máquina de Carnot No ciclo: ∆U=0 → = Q1 - Q2 η = /Q1 = [Q1-Q2]/Q1 = 1 - Q2/Q1 Q2/Q1 = T2/T1 η = (1 - Q2/Q1) = (1 - T2/T1) BC e DA = adiabáticas η = 1 - T2/T1 Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T1 e T2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios"
Download