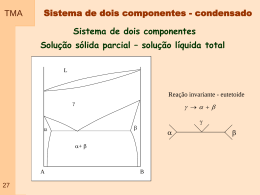
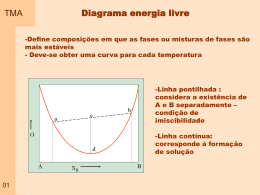
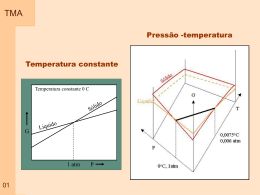
TMA Capitulo 01 – Propriedade dos Gases Gás: Pode ser visto como um conjunto de moléculas ou átomos em movimento permanente e aleatório, com velocidades que aumentam quando a temperatura se eleva. - não apresentam volume ou forma definidos - apresentam baixa densidade - todos apresentam respostas semelhantes ao efeito de temperatura e pressão As variáveis de estado: volume que ocupa ( V ) quantidade de matéria envolvida (n – número de moles) pressão ( p ) temperatura ( T ) Equação de estado: p f T , V , n Exemplo de equação de estado: 01 p nRT V Pressão TMA Definição: A pressão é dada pelo quociente entre a força exercida por área de atuação. A unidade no SI de pressão é o Pascal (Pa) – newton por metro quadrado Unidades: 02 Nome Símbolo Valor Pasca 1 Pa 1Nm-2, 1Kgm-1s-2 Bar 1 bar 105 Pa Atmosfera 1 atm 101325 Pa Torr 1 torr 101325/760 Pa Milimetro de mercúrio 1mmHg 133,322 Pa Libra por polegada2 1 psi 6,894747 kPa Pressão TMA Exemplificação: Dois blocos de mesma massa. O dois blocos exercem a mesma Força mas em áreas diferentes. A pressão em um gás confinado é o resultado do impacto das partículas com a fronteira ( parede) que o contem. Os conceitos associados variação com a altitude 03 a pressão atmosférica e sua TMA Medida da pressão Barômetro: Foi inventado no século 17 por um italiano – Evangelista Torricelli Descrição: Consiste em um tubo de vidro vertical, fechado em uma extremidade, imerso com a extremidade aberta em um recipiente contendo um líquido. Funcionamento: o líquido atinge uma altura no tubo em que o peso da coluna de líquido é igual à pressão exercida (atmosférica) Equilíbrio Mecânico. Se o liquido for o mercúrio a coluna deve subir 760 mm, que corresponde a pressão atmosférica padrão. 04 P gh cos TMA Medida da pressão Manômetro: Modificação de um barômetro pressões de um gás contido em um recipiente Descrição: Consiste em um tubo de vidro em U, parcialmente preenchido com mercúrio, com uma extremidade conectada no recipiente e a outra podendo estar fechada ou aberta. Funcionamento: Mesmo princípio de funcionamento do barômetro, sendo que o equilíbrio é atingido no balanço do peso da coluna de mercúrio com a pressão do recipiente e a pressão na extremidade oposta 05 para medir TMA Volume Definição: É simplesmente o espaço ocupado pelas moléculas do gás que estão livres para se movimentar Unidades: O valor de volume é dado em centimetro cubico, no sistema internacional, mas comumente trabalha-se com litro e mililitro. 06 TMA Temperatura Definição: É a propriedade que nos informa o sentido do fluxo de energia na forma de calor. A temperatura aumenta no sentido de quem recebe o calor (energia) Equilíbrio Definição: Existem várias escalas para medida de temperatura. Estas escalas podem ser determinadas pela medida do comprimento de uma coluna líquida ou gasosa. Os limites das escalas são definidos com base no ponto de gelo e ponto de vapor 07 TMA 08 Medida de Temperatura Fronteira Diatérmica Fronteira adiabática Sistemas–Fronteiras-temperaura TMA Medida de Temperatura Medir a temperatura corretamente é muito importante em todos os ramos da ciência, seja a física, a química, a biologia, etc. Muitas propriedades físicas dos materiais dependem da sua temperatura. Por exemplo, a fase do material, se ele é sólido, líquido ou gasoso, tem relação com sua temperatura. A temperatura revela a noção comum do que é quente ou frio. O material ou substância que está à temperatura superior é dito o “material quente”, No nível microscópico, a temperatura está associada ao movimento aleatório dos átomos da substância que compõem o sistema. Quanto mais quente o sistema, maior é a freqüência de vibração dos átomos. A temperatura é uma propriedade intensiva de um sistema A temperatura é a propriedade que governa o processo de transferência de calor (energia térmica) para e de um sistema. 09 TMA Medida de Temperatura Há dois sistemas de unidades em que escalas de temperatura são especificadas. No Sistema Internacional de Unidades, SI, a unidade básica de temperatura é o grau Kelvin (K). O grau Kelvin é formalmente definido como sendo (1/273,16) da temperatura do ponto triplo da água, isto é, a temperatura na qual a água pode estar, em equilíbrio, nos estados sólido, líquido e gasoso. A temperatura de 0 K é chamada de zero absoluto, correspondendo ao ponto no qual moléculas e átomos têm o mínimo de energia térmica. Nas aplicações correntes do dia-a-dia usa-se a escala Celsius, na qual o 0 oC é a temperatura de congelamento da água e o 100 oC é a temperatura de ebulição da água à pressão atmosférica ao nível do mar. Em ambas as escalas a iferença de temperatura é a mesma, isto é, a diferença de temperatura de 1 K é igual à diferença de temperatura de 1 oC, a referência é que muda. A escala Kelvin foi formalizada em 1954. 10 TMA Medida de Temperatura Existem muitos métodos de se medir a temperatura. A maioria deles baseiase na medição de uma propriedade física de um material, propriedade esta que varia com a temperatura. 1expansão da substância, provocando alteração de comprimento, volume ou pressão. 2alteração da resistência elétrica; 3- alteração do potencial elétrico de metais diferentes; 4- alteração da potência radiante, e 5alteração da intensidade de carga elétrica em um fotodiodo 11 T e rm o m e tro L iq u id o o rg â n ic o e m v id ro T e rm o m e tro M e rc u rio e m v id ro T e rm o m e tro líq u id o T e rm o m e tro P re s s ã o d e V a p o r T e rm o m e tro b im e tá lic o T e rm o m e tro d ila to m é tric o T e rm o m e tro re s is tê n c ia T e rm o m e tro te rm is to r T e rm o p a r P iro m e tro d e ra d ia ç ã o to ta l P iro m e tro fo to e lé tric o P iro m e tro p o r d e s a p a re c im e n to fila m e n to P iro m e tro d e d u a s c o re s -2 0 0 0 500 1000 T e m p e ra tu ra 1500 o C 2000 TMA Medida de Temperatura Termômetros de Expansão Charles, em 1787, e Gay-Lussac, em 1802, descobriram que volumes idênticos de gases reais (tais como oxigênio, nitrogênio, hidrogênio, dióxido de carbono e ar) expandiam-se da mesma quantidade para um determinado aumento de temperatura sob condições de pressão constante. Indice 0 – indica ponto de referencia – fusão do gelo. Indice p – indica que o processo ocorre a pressão constante. 12 TMA Medida de Temperatura Termômetros Bimetálico O termômetro bimetálico opera de acordo com o princípio de expansão linear de metais. Um par de hastes metálicas de materiais distintos (o chamado bimetálico), soldadas, dilatam-se diferencialmente causando a flexão do conjunto. Esta flexão aciona um dispositivo indicador da temperatura. A temperatura T está relacionada à expansão linear L pela relação – coeficiente expansão térmica O termômetro bimetálico é aplicável de -50oC a +500oC, com uma incerteza típica (menor divisão) de 1% do fundo de escala. Têm tempo de resposta elevado, entre 15 e 40 s. Os materiais mais empregados na construção dos bimetálicos são o invar, o monel, o inconel e o inox 316. São instrumentos baratos e de baixa manutenção. P.ex. indicadores de temperatura de cafeteiras. 13 TMA Medida de Temperatura Termômetros de Bulbo O termômetro de bulbo é um dos dispositivos mais comuns neste grupo de termômetros de expansão para a medição de temperatura de líquidos e gases. Operam a partir da variação volumétrica de um líquido (álcool, fluidos orgânicos variados e mercúrio) com a temperatura, de acordo com a equação abaixo – coeficiente expansão volumétrico Álcool e mercúrio são os líquidos termométricos mais comumente utilizados. O álcool tem um coeficiente de expansão volumétrica mais elevado do que o Hg, isto é, tem maior (du/dt). Sua aplicação está limitada, porém, a uma faixa de medidas inferior, devido ao seu baixo ponto de ebulição. O mercúrio, por outro lado, não pode ser utilizado abaixo do seu ponto de fusão (-37,8 C). 14 TMA Medida de Temperatura Termômetros de Resistência São chamados de termômetros de resistência aqueles em que os sensores de temperatura são resistências elétricas. Estas resistências elétricas variam com a temperatura do meio onde estão inseridas e um circuito elétrico (eletrônico) registra esta variação. Os diversos tipos de sensores utilizados são apresentados a seguir. Termometro de Resistência elétrica RTD (Resistance Temperature Detector): estes sensores de termômetros de resistência são elementos que apresentam variação direta da resistência com a temperatura. Atualmente o termômetro mais preciso utilizado para medidas referenciais é um RTD. A resposta de um RTD é indicada pelo coeficiente de temperatura linear da resistência, . Indice 0 – condição de referência 15 Os valores de referência, Ro e To, especificam os sensores, por exemplo PT100 é um sensor de platina (pt) que tem resistência Ro = 100 W à temperatura To = 0 ºC. TMA Medida de Temperatura Termômetros de Termistores O material dos termistores é um semicondutor que, no intervalo fundamental (0oC a 100oC), pode apresentar variação da resistividade de 10 kohm a 0ºC até 200 ohm a 100ºC, como mostra a figura seguinte. Curvas como esta, definem um termistor. Por isso, um termistor é um NTC (negative temperature coefficient device) RTD 16 Termistor Medida de Temperatura TMA Termopar Um termopar é formado por dois condutores elétricos diferente. Os condutores são conectados nas duas extremidades formando um circuito elétrico. Quando as duas extremidades conectadas são submetidas a temperaturas diferentes, uma força eletromotriz é gerada. Este é o conhecido efeito Seebeck, que o descobriu em 1821. 17 Medida de Temperatura TMA Termopar 18 TMA A lei dos Gases Ideais p nRT V As leis empíricas dos Gases: Robert Boyle em 1661 – massa constante e temperatura constante pV cte Lei de Boyle – a temperatura constante, a pressão de uma amostra de gás é inversamente proporcional ao seu volume e o volume da amostra é inversamente proporcional à pressão: p 1 V 19 e V 1 p TMA Representação gráfica da lei de Boyle Isoterma 20 Isotérma – curva que representa o comportamento de uma propriedade a temperatura constante TMA As leis empíricas dos Gases Ideais Jacques Charles – massa constante e pressão constantes V k x T 273 Lei de Charles – pode ser escrita na seguinte forma: p cte x T (a volume constante) V cte x T (a pressão constante) Gay-Lussac – volume varia linearmente com a temperatura V V Vo T T p 1 V 0 V0 T p V a bT V V0 t 21 1 V V o 1 0 T V o 0 T 0 TMA Representação gráfica da lei de Charles Isobara 22 Isobara (isobárica) – curva que representa o comportamento de uma propriedade a pressão constante TMA A lei dos Gases Ideais – efeito da massa Princípio de Avogadro – Volumes iguais de gases, nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas Vm V independe do gás (em uma certa P e T) n Corresponde a dizer que o volume é proporcional ao número de moles presentes e que a constante de proporcionalidade independe da identidade do gás pV cte x nT cte R R 8 ,3 14 5 1 J K -1 m o l 8 ,3 14 5 1 P a m 3 K -1 m o l –1 8 ,2 0 5 7 8 x 10 -2 L a tm K -1 m o l 23 6 2 ,3 6 4 L to rr K -1 m o l –1 –1 –1 8 ,3 14 5 1 x 10 -2 L b a r K -1 m o l 1,9 8 7 2 2 ca l K -1 m o l –1 –1 TMA 24 Representação gráfica da lei de gás ideal TMA Mistura de Gases Lei de Dalton – A pressão exercida por uma mistura de gases ideias é a soma das pressões parciais dos gases Para uma mistura de gases Para cada componente da mistura pV n t RT pi A mistura em termos de pressão parcial n i RT V p pi Volume parcial molar pV n t RT n i RT Vi Para cada componente da mistura P A mistura em termos de pressão parcial V Vi Para uma mistura de gases 25 Pressão Parcial TMA p i X ip p pA pB X X A XB n nA nB 26 Os Gases Reais TMA Comportamento: Os gases reais tem seu comportamento diferenciado dos ideais e este desvio é explicado pelas interações moleculares Tipos de interação: Forças atrativas contribuem para a compressão Forças repulsivas contribuem para a expansão 27 TMA Os Gases Reais Interações Intermoleculares 28 TMA Fator de compressibilidade Definição: relação entre volume do gas real pelo volume do gás com comportamento ideal Z pV m RT 29 Volume molar de gases TMA Nas condições padrões Gás Gás ideal Amônia Argônio Dióxido de Carbono Nitrogênio Oxigênio Hidrogênio Hélio *A STP (ooC, 1 atm) Vm= 24,4140 30 Vm (dm3mol-1) 24,7896* 24,8 24,4 24,6 24,8 24,8 24,8 24,8 TMA Z – Representação Gráfica Z pV m RT Para um gás ideal Z = 1 Para pressões muito baixas Z = 1 para todos os gases Para pressões elevadas Z > 1 (mais difícil comprimir) Para pressões intermediárias Z < 1 (mais fácil comprimir) 31 TMA 32 Gás Ideal x Gás Real TMA Gás Ideal x Gás Real Gás Ideal 33 Gás Real TMA Gás Ideal x Gás Real A velocidade da bola verde ao colidir com a parede é diminuída pelas forças atrativas com as bolas vermelhas. a pressão de um gás real é menor quanto maior for a atração entre suas partículas. A partícula do gás real tem volume real 34 Novas equações TMA Uma modificação da lei geral dos gases foi proposta por Johannes Van der Waals em 1873, levando em conta o tamanho das partículas e as interações intermoleculares. Esta é conhecida como a Equação de Estado de van der Waals. p 38 RT V m b Na Equação de Estado de van der Waals, o parâmetro a corrige a pressão ideal para a pressão real e está relacionado às forças atrativas entre as partículas do gás. O parâmetro b corrige o volume molar e relaciona-se com o tamanho destas partículas. a V 2 m TMA Temperatura de Boyle Definição: Na temperatura de Boyle as propriedades do gás real coincidem com as do gás perfeito nas pressões baixas. Existe uma temperatura TB onde o gás se comporta como um gás perfeito por uma ampla faixa de pressão 35 TMA Comportamento Real/Coordenada Crítica T 36 TMA Princípio do estado correspondente pr 37 p pc Vr V Vc Tr T Tc TMA 39 Novas equações TMA 40 Novas equações Equações de estado TMA Equação Gás perfeito p p Dieterici p RT V m b RT V m RTe b Pr 2 Vm a a RTV V m a TV m Pr 2 m 41 8 Tr 3Vr 1 8 Tr 3Vr 1 2 Pr b 1 RT V m 2 Vm p Vc Tc RT Beattle-Bridgman p Virial Pc Vm Van der Waals p Berthelot Forma Reduzida RT B T C T ..... 1 2 Vm Vm Vm e Tr e 3 a 2 Vr 27 b 3 2 TV r 2 / Tr Vr 3b 2 1 2 aR 3 12 3 b 8a 27 bR 1 2 2 2a 3b 3 3 bR a 2 Vr 1 2 4e b a com a 0 1 V m b a 0 1 V m C0 3 Vm T 2 2b a 4 bR 1 2 TMA 42 Equações de estado TMA Exercício A densidade do vapor de água a 327,6 atm e 503,25 ºC é 1,332x102 g/L. Sabendo-se que: Tc=374,25 ºC, Pc = 218,3 atm, a=5,464 L2atm/mol2, b=0,0305 Lmol-1, M=18,02 g/mol. Determine: (a) o volume molar usando os dados disponíveis, sem fazer considerações sobre o comportamento do material; (b) o volume molar considerando o comportamento de um gás ideal; (c) o volume molar considerando o comportamento de um gás real, utilizando como ferramenta o fator de compressibilidade obtido do diagrama de relação de compressibilidade; (d) o volume molar considerando o comportamento de um gás de Van der Walls; 43 com base nos resultados obtidos, qual é o tipo de força de interação predominante entre as moléculas neste caso. TMA 37 Exercício
Download