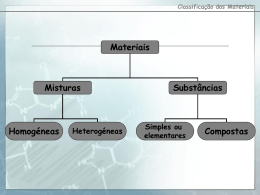
CORRECÇÃO DO TESTE SUMATIVO 9º Ano ANO LECTIVO: 2007/2008 DURACÇÃO: 90 m Questão CORRECÇÃO Nº 1. 1.1 DATA: 05/05/08 1º TESTE/ 3º PERÍODO A = Z + nº de neutrões 2a-4 = a-2 + 8 <=> a = 10 Como o que determina o elemento é o nº atómico (Z) temos de o calcular. Z = 10-2 = 8 que corresponde ao oxigénio 2. O que define o elemento a que pertence um átomo é o seu número de protões. 3. Isótopos são átomos com o mesmo número atómico mas diferente número de massa. 4. 4a) 4b) 5. C2H2 e N2 O2, CO2 e C2H4 Moléculas com ligações polares apresentam ligações entre átomos diferentes pois têm capacidades diferentes para atrair os electrões das ligações. Neste caso são NH3 e CO2. 6. 6A 6B 6C 6D 6E 6F …núcleo…protões…neutrões…núcleo…electrões. …neutras…protões…electrões…positiva…negativa. …maior…orbital. …átomos…diferentes. …substâncias…átomos…elemento. …substância…elementos…átomos…molécula. 7. 7A 7B 7C 7D F, …são do mesmo elemento. V F, …10. F, …a um estado excitado. 1 8 8.1 Iões Q- e A2+. 8.2 Ligação iónica envolve forças electrostáticas que atraem iões de cargas opostas. 9 9a) A:2;8;5 E:2;8;8;2 Unindo os átomos por ligação covalente não conseguiríamos que obedecessem à regra do octeto. No entanto se formassem iões A3- e E2+ poderia formar-se o ião E3A2. 9b) C:2;6 Podemos então ter a molécula C=C tendo cada átomo mais 2 pares de electrões não ligantes e obedecendo à regra do octeto. 9c) A:2;8;5 Podemos então ter a molécula C≡C tendo cada átomo mais 1 pares de electrões não ligantes e obedecendo à regra do octeto. 9d) D:2;8;1 Pela distribuição electrónica vemos que se trata de um metal (1 electrão de valência), vai-se ligar então por ligação metálica. 10 10a) Etanol 10b) Propanona 10c) Ácido etanóico 10d) 11 CH3-CH2-CH2-CH=CH-CH3 2-hexeno 2-hexeno 12 2 12a) 12b) H-C≡C-H 12c) 12d) 13 14 CH3-CH-CH2-CH-CH2-CH2-CH3 │ │ CH3 CH2-CH3 Dalton defendia: - A matéria é composta por pequenos corpúsculos, que não se subdividem – os átomos - Os átomos do mesmo elemento são iguais entre si – têm a mesma massa -A matéria é formada pela união de diferentes átomos em proporções definidas. Thomson defendia a existência de cargas no átomo. Ele formulou a hipótese de que o átomo se subdividia em partículas negativas e numa esfera maciça de carga positiva. 3
Download