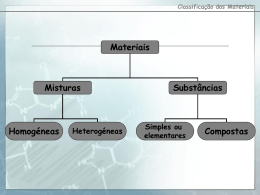
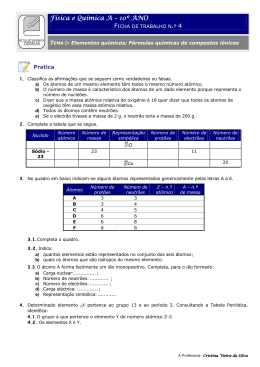
Escola Básica e Secundária Gonçalves Zarco Física e Química A, 10º ano Ano lectivo 2007 / 2008 Correcção do teste de avaliação sumativa Nome: ____________________________________ Classificação : __________________ N.º aluno: ______ Turma: _____ Professor:_________________ Grupo I 1. Os rótulos seguintes dizem respeito a alguns produtos alimentares. 1.1. Qual destes produtos é uma mistura heterogénea? Justifica a tua resposta. Os cogumelos são uma mistura heterogénea porque não apresentam um aspecto uniforme. 1.2. Qual destes três produtos poderá ser considerado uma substância? O aroma de baunilha (vanilina) 1.3. Indica um ingrediente que seja uma substância composta. Indica a respectiva fórmula química. O sal (cloreto de sódio), NaCl 1.4. Um dos rótulos refere como ingrediente uma substância simples. Qual é essa substância? A prata 2. Considera o elemento X. 2.1. Calcula a massa atómica do elemento X, sabendo que este elemento tem três isótopos de massas isotópicas, respectivamente 50,80; 52,20 e 53,00 com abundâncias relativas de 80,0%; 15,1% e 4,9% respectivamente. Ar(X) = (50,80 × 80,0) + (52,20 × 15,1) + (53,00 × 4,9) = 51,12 100 Núcleo de Estágio 07/08 1 2.2. Explica o significado do termo “massa atómica relativa”. A massa atómica relativa de um elemento pode definir-se como a média ponderada das massas isotópicas relativas dos isótopos desse elemento. 2.3. Calcula a massa molecular relativa e massa molar de: i) H3PO4 ii) Ca(OH)2 Massa molecular relativa: Mr (H3PO4) = (3x1,00) +30,97 +(4x16,00) = 97,97 Mr (Ca(OH)2) = 40,08+(2x16,00) + (2x1,00) = 74,08 Massa molar: MM (H3PO4) = 97,97 g/mol MM (Ca(OH)2) = 74,08 g/mol Dados: Ar (H) = 1,00 Ar (P) = 30,97 Ar (O) = 16,00 Ar (Ca) = 40,08 3. A figura mostra valores apresentados num rótulo de uma água engarrafada: Composição Resíduo seco (a 180 ºC)………….85,4 mg/l mg/l Cloreto (Cl-)......................................23,8 Sulfato (SO42-)……..........................11,0 Bicarbonato (HCO3-)………………14,6 Fluoreto (F-)………………………....0,1 Sílica (SiO2)………………………..13,4 5. mg/l Sódio (Na+)………………………...20,7 Potássio (K+)………………………...1,1 Cálcio (Ca2+)………………………...3,2 Magnésio (Mg2+)……………………1,2 CO2 livre…………………………….70 Para ingerir 4,8 g de cálcio, que volume de água se deveria beber? Deveria ingerir 1500 litros de água. 6. Qual é a massa de ião cloreto existente numa garrafa de capacidade 1/4 de litro? 5,95 mg de ião cloreto. 7. Calcula a massa total de iões positivos existentes numa garrafa de meio litro. 13,1 mg 4. Indica quais das seguintes afirmações são falsas e explica porquê. 4.1. O átomo de 168 O tem o mesmo número de protões, de neutrões e de electrões. Verdadeira. 4.2. Os átomos de 12 6 Ce 13 6 C são isótopos, porque têm o mesmo número de neutrões. Falsa, pois para os átomos serem isótopos têm de ter o mesmo número protões. Núcleo de Estágio 07/08 2 4.3. Os átomos de 3 Li têm 3 electrões. Verdadeira. 4.4. Há átomos que têm mais protões do que electrões. Verdadeira. 4.5. Todos os átomos têm neutrões. Falsa, pois há o caso do hidrogénio que não tem neutrões. 4.6. Todos os átomos têm protões. Verdadeira. 4.7. Um anião tem mais protões do que electrões. Falsa, pois um anião tem mais electrões do que protões. 4.8. O catião 23 11 Na + tem 11 electrões. Verdadeira. 5. O esquema seguinte representa um pequeno extracto da Tabela Periódica. 5.1 Preenche o esquema colocando os elementos genericamente representados pelas letras A a J, de acordo com as informações seguintes: (A) O elemento A tem número atómico 10; (B) A carga nuclear dos átomos do elemento B é +12; (C) O elemento C é o quinto elemento do 2º período; (D) O elemento D é um halogéneo e é o segundo elemento do seu grupo; (E) O elemento E pertence ao grupo 5 e ao 4º período; (F) O elemento F é o metal alcalino do período onde se situa o elemento E; (G) O número atómico do elemento G é igual a ZB+1; (H) Os átomos do elemento H têm menos um protão que os do elemento D; (I) O elemento I é o único que tem átomos sem neutrões; (J) O elemento J tem propriedades muito semelhantes ao elemento B mas pertence ao período seguinte. Núcleo de Estágio 07/08 3 GRUPO II 1. Considera o esquema da montagem laboratorial representado na figura. 1.1. Indica o nome do processo de separação representado na figura. Destilação fraccionada. 1.2. Faz a legenda da figura. 1- balão de fundo redondo, 2- coluna de destilação, 3- termómetro, 4- saída de água, 5- condensador, 6- entrada de água, 7- proveta, 8- suporte universal. 1.3. Indica a função do material assinalado com o número 5. A função do condensador é a passagem do gás para líquido. 1.4. Indica as mudanças de estado físico que ocorrem no processo. Vaporização - passagem de liquido para gás, Condensação - passagem de gás para líquido. 1.5. Em geral, o processo de separação esquematizado pode ser efectuado sem utilizar o dispositivo 2. Explica em que situações é que esta peça deve ser utilizada e quando é que não é necessária. Quando os pontos de ebulição dos líquidos a separar são afastados. 2. Na figura está reproduzido o rótulo de um produto utilizado em limpezas industriais. 2.1. Qual o significado dos símbolos indicados? Tóxico e corrosivo. 2.2. Que cuidados devemos ter no manuseamento deste produto? Usar bata, óculos, máscara e luvas de protecção. Núcleo de Estágio 07/08 4 3. Pretende-se separar uma mistura de óleo, água e álcool etílico. Sabendo que o álcool etílico não é solúvel no óleo, indique os dois processos de separação, A e B, que permitem obter os diversos constituintes desta mistura, de acordo com o esquema: Óleo + água + álcool Processo A Óleo Água + álcool Processo B Água Álcool Processo A: Decantação líquido-líquido. Processo B: Destilação simples. 4. Das proposições seguintes identifique as verdadeiras e corrija as falsas: A. Uma filtração será mais lenta se previamente tiver sido realizada uma decantação. Falsa B. Uma destilação fraccionada utiliza-se para separar misturas de líquidos com pontos de ebulição próximos. Verdadeira C. A decantação permite separar misturas heterogéneas de sólidos em líquidos. Verdadeira D. Numa destilação a água fria deve entrar sempre pela parte superior do condensador. Falsa 5. Vários alunos mediram o comprimento de uma mesma peça, tendo registado os seguintes valores: 14,95 cm 15,0 cm 14,70 cm 15,02 cm Para o efeito utilizaram uma régua normal, em que a menor divisão da escala era 1 mm. 5.1. Um dos valores está indevidamente registado. Explica porquê. 15,0 cm, porque os resultados deveriam apresentar duas casas decimais, uma vez que foi utilizado uma régua normal, em que a menor divisão era o mm. 5.2. Para verificar as medidas efectuadas utilizou-se um equipamento de medida muito sensível. O valor obtido foi 13,00 cm. Considerando este valor, comente a exactidão das medições efectuadas pelos alunos. Núcleo de Estágio 07/08 5 Como o valor médio está afastado do valor verdadeiro as medidas não são exactas. 5.3. Que tipo de erros terão afectado as medições? Erros sistemáticos. 6. A figura exibe o mostrador de uma calculadora. Caso se pretenda considerar apenas três algarismos significativos, que valor indica a calculadora? DEG 492.776368003 A – 493000 Núcleo de Estágio 07/08 B – 492 C – 493 x 103 D – 4923 6
Download