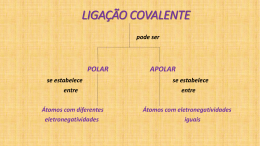
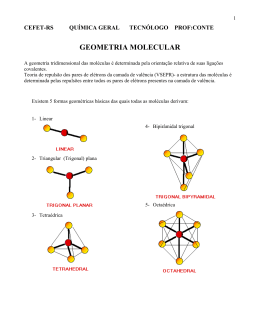
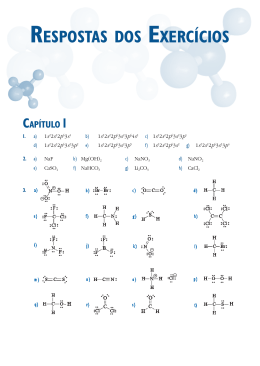
AVALIAÇÃO – 2º BIMESTRE - RECUPERAÇÃO CAMPO GRANDE–MS, 09 DE JULHO DE 2010. Série: NOTA 1ª Nº Sala: LISTA DE REVISÃO - QUÍMICA 1 - 1°ANO– PROF.BEAN Tipo U ® 1. (Unicamp) Observe as seguintes fórmulas eletrônicas (fórmula de Lewis): Consulte a Classificação Periódica dos Elementos e escreva as fórmulas eletrônicas das moléculas formadas pelos seguintes elementos: a) fósforo e hidrogênio; b) enxofre e hidrogênio; c) flúor e carbono. 2. (BEAN 2025) Qual a fórmula molecular do composto formado entre o hidrogênio, H(Z = 1) e o cloro, CØ (Z=17)? 3. (BEAN 2025) O ácido hipocloroso é formado por um átomo de hidrogênio (Z=1), ligado a um átomo de oxigênio (Z=8) que está ligado a um átomo de cloro (Z=17). Como podemos representar a sua fórmula estrutural plana? 4. (BEAN 2025) Dar a fórmula estrutural plana do gás carbônico (CO‚). Dados: C (Z=6) e O (Z=8) 5. (Ufrn) Considere as seguintes moléculas: H‚O; PC؃; BHƒ; SF„ e CO‚. a) Indique as espécies polares. Justifique. b) Indique as espécies apolares. Justifique. 6. (Ita) Assinale a opção que contém a afirmação ERRADA a respeito das seguintes espécies químicas, todas no estado gasoso: H‚ ; HCØ; HF; PC؃ ; PCØ… a) A ligação no H‚ é mais covalente e a no HF é a mais iônica. b) O H‚ e o HCØ são, ambos, diamagnéticos. c) O PCØ… tem um momento de dipolo elétrico maior do que o PC؃. d) O H‚ e o PCØ… NÃO possuem momento de dipolo elétrico permanente. e) O H‚ pode ter momento de dipolo elétrico induzido. 7. (Puccamp) O nitrogênio gasoso, N‚, pode ser empregado na obtenção de atmosferas inertes; o nitrogênio líquido é utilizado em cirurgias a baixas temperaturas. Qual é o tipo de ligação química existente entre átomos na molécula N‚, e que forças intermoleculares unem as moléculas no nitrogênio líquido? a) Tipo de Ligação química: covalente apolar Forças intermoleculares: van der Waals. b) Tipo de Ligação química: covalente polar Forças intermoleculares: pontes de hidrogênio. c) Tipo de Ligação química: iônica Forças intermoleculares: van der Waals. d) Tipo de Ligação química: metálica. Forças intermoleculares: pontes de hidrogênio. e) Tipo de Ligação química: covalente polar Forças intermoleculares: ação dipolo-dipolo. 8. (Ita) Em relação a estrutura eletrônica do tetrafluoreto de carbono, assinale a opção que contém a afirmativa ERRADA: a) Em torno do átomo de carbono tem-se um octeto de elétrons. b) Em torno de cada átomo de flúor tem-se um octeto de elétrons. c) A molécula é apolar, embora contenha ligações polares entre átomos. d) A molécula contém um total de 5.8=40 elétrons. e) Os ângulos das ligações flúor-carbono-flúor são consistentes com a hibridização sp¤ do carbono. 9. (Pucmg) Sejam dadas as seguintes moléculas: H‚O, BeH‚, BC؃ e CCØ„. As configurações espaciais dessas moléculas são, respectivamente: a) angular, linear, trigonal, tetraédrica b) angular, trigonal, linear, tetraédrica c) angular, linear, piramidal, tetraédrica d) trigonal, linear, angular, tetraédrica 10. (Ufsc) Considere a tabela a seguir e selecione a(s) proposição(ões) que relaciona(m) CORRETAMENTE a forma geométrica e a polaridade das substâncias citadas: 01. H‚O: angular e polar. 02. CO‚: linear e apolar. 04. CCØ„: trigonal e polar. 08. NHƒ: piramidal e polar. 16. CCØ„: tetraédrica e apolar. GABARITO 1. Observe a figura a seguir: 2. HCØ 3. H-O-CØ 4. O=C=O 5. a) H‚O, PC؃ (˜r · 0) b) BHƒ, SF„ e CO‚ (˜r = 0) 6. [C] 7. [A] 8. [D] 9. [A] 10. 01 + 02 + 08 + 16 = 27
Download