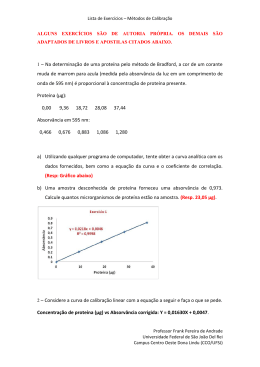
Universidade do Algarve ESSaF Química / Química Geral e Inorgânica Análises Clínicas e Saúde Pública, Dietética e Nutrição, Farmácia 13 Trabalho Prático Nº 4: “Determinação da constante de equilíbrio de uma reacção” Objectivo: Familiarizar os alunos com a espectroscopia de visível e a sua aplicação à determinação da concentração de soluções. Exemplificar um modo de determinação da concentração de espécies num sistema em equilíbrio. Introdução: A reacção do ião férrico com o ião tiocianato é uma reacção incompleta, estabelecendo-se o seguinte equilíbrio: 3+ Fe (aq) + SCN (aq) amarelo-pálido incolor FeSCN 2+ (aq) vermelho Devido à formação do ião tiocianoferrato (III) - FeSCN2+ - que absorve luz nas regiões azul – azul esverdeado (430-490 nm), a solução adopta uma coloração vermelho-escura. Por este facto, é possível determinar a concentração de produto presente no equilíbrio - e, consequentemente, as concentrações dos reagentes - recorrendo à espectrofotometria de visível, por aplicação da Lei de Lambert-Beer. Esta relaciona a absorvância (fracção de luz absorvida) de uma solução com a sua concentração e exprime-se através da equação: A=ε.l.C onde A é a absorvância (valor da leitura efectuada no espectrofotómetro), grandeza adimensional, ε é o coeficiente de absorção molar, característico de cada substância a cada comprimento de onda, l é a largura da célula que contém a solução, e tem o valor de 1 cm, e C é a concentração molar da solução. 2+ Na preparação de soluções de concentração conhecida de FeSCN , para traçar a recta de calibração, que permite calcular o valor de ε para este composto ao comprimento de onda de trabalho (477 nm), usa-se um grande excesso de ião férrico relativamente ao ião tiocianato, por forma a garantir um deslocamento do equilíbrio no sentido da formação do produto, podendo-se admitir que a concentração deste é igual à concentração inicial de SCN-. Procedimento experimental: Recta de calibração 1. Numere 5 balões volumétricos de 25 mL. 2. Pipete os seguintes volumes para cada um dos balões: Balão 1 2 3 4 5 KSCN (0,002 M) / mL 1 2 3 4 5 Fe(NO3)3 (0,2 M) / mL 5 5 5 5 5 3. Complete os volumes com água destilada e homogeneíze. 4. Meça a absorvância das soluções a 477 nm, usando como branco água destilada. Note que as células têm duas faces transparentes e duas opacas: tenha sempre o cuidado de lhes pegar pelas faces opacas e de, ao introduzi-las no compartimento do aparelho, o fazer de forma a que sejam as faces transparentes a ficar no percurso da luz. Universidade do Algarve ESSaF Química / Química Geral e Inorgânica Análises Clínicas e Saúde Pública, Dietética e Nutrição, Farmácia 14 Determinação da composição do sistema no equilíbrio 1. Numere 5 tubos de ensaio. 2. Pipete os seguintes volumes para cada um deles: Tubo 1 2 3 4 5 KSCN (0,002 M) / mL 1 2 3 4 5 Fe(NO3)3 (0,002 M) / mL 5 5 5 5 5 H2O / mL 4 3 2 1 0 3. Homogeneíze bem as soluções. 4. Meça a absorvância das soluções a 477 nm, usando como branco água destilada. Anexo Figura 1. Espectro da radiação electromagnética Tabela 1. Cores e respectivas Cores Complementares do Espectro da Radiação Visível λ / nm 400 - 430 430 - 480 480 - 490 490 - 510 510 - 530 530 - 570 570 - 580 580 - 600 600 - 680 680 - 750 Cor Violeta Azul Azul Esverdeado Verde Azulado Verde Amarelo Esverdeado Amarelo Laranja Vermelho Púrpura Cor complementar Verde Amarelado Amarelo Laranja Vermelho Púrpura Violeta Azul Azul Esverdeado Verde Azulado Verde
Download