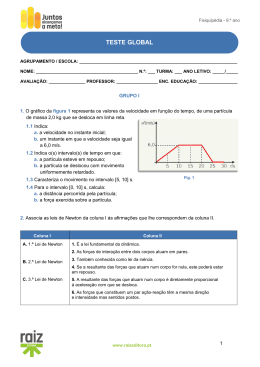
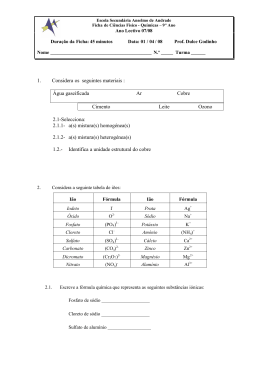
ESCOLA A N T E R O 8º ANO BÁSICA 3/S DE QUENTAL CIÊNCIAS FÍSICO-QUÍMICA ANO LECTIVO 2002/2003 Ficha de Avaliação Nome:_______________________________________________ Nº _____ Turma: D Classificação: __________ O professor: __________________O encarregado de educação:____________ 1. Classifica como verdadeiras (V) ou falsas (F) as seguintes afirmações: a) Os átomos são corpúsculos electricamente neutros. b) O átomo é constituído pelo núcleo e pela nuvem electrónica. No núcleo encontram-se os electrões e na nuvem electrónica encontram-se os protões. c) Uma molécula é um corpúsculo electricamente neutro. d) O electrão é uma partícula com carga eléctrica negativa. e) Os iões tem carga eléctrica positiva ou negativa. f) Os iões com carga eléctrica negativa designam-se por catiões. 2. Completa o seguinte quadro: Representação Nº de moléculas Nº de átomos de azoto (N) Nº total de átomos 4 HNO3 6 NO2 CH3 NH2 3. Completa a seguinte tabela: Número atómico Número de (Z) electrões Número de protões Elemento Químico 18 Jx Wn3+ 10 8 Y2- 1 X+ 4. Consultando a tabela de iões, selecciona a alternativa que permite completar correctamente a frase: “O carbonato de sódio (Na2 CO3 ) é... A - ... um composto iónico cujas unidades estruturais são iões.” B - ... constituído por iões carbonato e átomos de sódio.” C - ... é constituído por um ião carbonato, CO3 2-, e um ião sódio Na+.” 5. Escreve a fórmula química das seguintes substâncias iónicas: a) Hidróxido de sódio _________________________________________________________________ b) Cloreto de amónio _________________________________________________________________ c) Óxido de alumínio _________________________________________________________________ d) Permanganato de potássio _________________________________________________________________ 6. Escreve o nome dos seguintes compostos: a) NaCl ________________________________________________________ b) Mg(HO)2 _____________________________________________________ c) CaCO3 _______________________________________________________ d) Ca3 (PO4 )2 _____________________________________________________ 7. Provavelmente, já tiveste que limpar um ferimento com água oxigenada. Lembras-te da recomendação: “Não te esqueças de tapar o frasco da água oxigenada depois de a utilizares!” Sabes porquê? A água oxigenada é o peróxido de hidrogénio para os químicos, H2 O2 , e decompõe-se facilmente em água (H2 O) e oxigénio (O2 ): 2 H2O2 (aq) → 2 H2O (l) + O2 (g) a) Identifica os reagentes e os produtos da reacção que ocorre. _________________________________________________________________ b) Identifica os estados físicos presentes na equação. _________________________________________________________________ 8. Acerta as seguintes equações químicas de modo a que traduzam reacções químicas e se verifique a Lei de Lavoisier: a) Hg (l) + O2 (g) → HgO (g) b) N2 (g) + O2 (g) → NO2 (g) c) Na (s) + H2O (l) → d) KI (aq) + Pb(NO3)2 (aq) → IÕES POSITIVOS ião alumínio ião amónio ião cálcio ião magnésio ião potássio ião sódio NaHO (aq) + PbI2 (s) H2 (g) + KNO3 (aq) IÕES NEGATIVOS 3+ Al NH4 + Ca 2+ Mg2+ K+ Na+ ião brometo ião carbonato ião cloreto ião fosfato ião hidróxido ião óxido ião permanganato ião sulfureto BrCO3 2ClPO4 3HOO2MnO4 S2- Bom trabalho!!! Cotação: 1 2 3 6 x 3% 9 x 1% 8 x 2% 18% 9% 16% 4 3% 5 6 7 8 4 x 3% 4 x 3% 2 x 5% 4 x 5% 12% 12% 10% 20%
Download