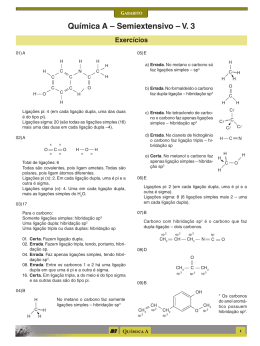
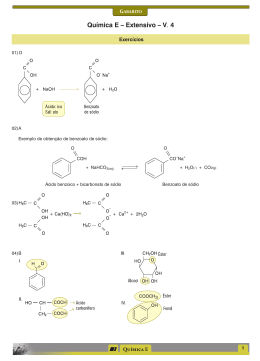
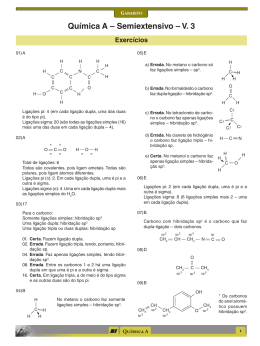
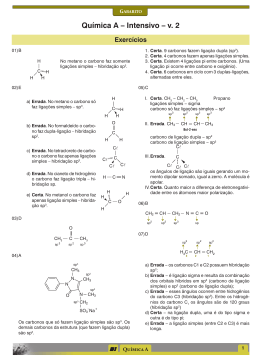
Vestibular UFRGS 2015 Resolução da Prova de Química 26. Alternativa (C) Assunto: Propriedades físicas das substâncias – densidade Os materiais apresentam diferentes densidades e mesma massa envolvida logo, m = d(diamante) x V 1 m = d(grafite) x V F d(diamante) x V 1 = d(grafite) x V F 3,5 g/cm3 x V 1 = 2,3 g/cm3 x V F V F = 3,5/2,3 V 1 = 1,5 V 1 27. Alternativa (C) Assunto: Propriedades físicas das substâncias – Ponto de Ebulição I – correta. Se a temperatura de ebulição for a mesma, provavelmente, trata-se da mesma substância. II – correta. O tempo de aquecimento da amostra B é menor, isto indica que temos uma massa menor no copo de béquer onde está a amostra B. III- errada. Nota-se que a temperatura de ebulição não variou durante a mudança de estado indicando a presença de uma substância pura. 28. Alternativa (E) Assuntos: Estrutura Atômica, cátions e ânions, isótopos Os dois isótopos são capazes de formar íons de carga +2 e +3, isto depende da estrutura do átomo. As formas isotópicas podem ser encontradas em qualquer um dos alótropos do ferro. 29. Alternativa (D) Assunto: Tabela periódica – propriedades periódicas I – errada. O bário (Ba) apresenta seis níveis de energia (sexto período), enquanto o zinco apresenta somente quatro níveis de energia (quarto período). II – Correta. Para o zinco (Zn), teremos: 30 elétrons – 2 elétrons = 28 elétrons restantes. Para o gálio (Ga), teremos: 31 elétrons – 3 elétrons = 28 elétrons restantes. São espécies isoeletrônicas. III – O potencial de ionização decresce para baixo e para a esquerda. O bário (Ba) é o elemento mais embaixo e mais à esquerda dos elementos citados na questão. 30. Alternativa (A) Assunto: Estado de oxidação – número de oxidação Determinando o Nox da prata nos compostos teremos, Ag Br Ag N O3 +1 -1 =O +1 +5 -2 +1 +5 -6 =0 31. Alternativa (C) Assuntos: Reações químicas, hidrólise salina O Li 2 CO 3 é solúvel em água. A água é uma substância molecular. Na hidrólise do Li 2 CO 3 , somente o ácido fraco (H 2 CO 3 ) se regenera, a base (LiOH), por ser forte não se regenera, fornecendo o caráter básico para a solução. Li 2 CO 3 + H 2 O → H 2 CO 3 + Li+ + OH- 32. Alternativa (B) Assunto: Aplicações dos elementos, cotidiano 1 – no espectro de luz visível a coloração amarela é característica do elemento sódio. 2 - lâmpada halógenas utilizam halogênio. O iodo é mais provável. 3 – a referência a gases inertes nos faz inferir a presença de um gás nobre e o fósforo quando excitado com a radiação gerada pela ionização dos gases produz luz visível. 33. Alternativa (B) Assuntos: Ligações químicas intermoleculares, geometria molecular (2) A substância é mais volátil que a água, porque suas ligações intermoleculares são mais fracas. A água possui ligações de hidrogênio entre as suas moléculas. (4) As moléculas que apresentam ligantes diferentes são polares, portanto solúveis em solventes polares. (1) Moléculas tetraédricas com ligantes idênticos são apolares, portanto, solúveis em solventes apolares. (3) Soluções eletrolíticas são formadas por substâncias que, em meio aquoso, formam íons, que são os responsáveis pela condução da corrente elétrica. 34. Alternativa (D) Assuntos: Forças intermoleculares, propriedades coligativas I – correta. As gotas de água tendem a ser redondas por causa do fenômeno chamado “tensão superficial”, que ocorre porque as moléculas da água atraem-se mutuamente em todas as direções. Mas, na superfície, as moléculas só são puxadas para dentro da água, porque não existem moléculas puxando na direção oposta. II- errada. A pressão de vapor da água diminui, porque o acréscimo de um soluto não-volátil “atrapalha” a evaporação da água líquida. III- correta. A sacarose, por ter grupos hidroxila fortemente polares na sua estrutura, estabelece com a água ligações de hidrogênio. 35. Alternativa (B) Assunto: Estequiometria – pureza do reagente 1,0 tonelada ................. 100% x toneladas .............. 5% x = 0,05 toneladas = 50 kg de FetiO 3 152 gramas de FeTiO 3 ....................... 80 gramas de TiO 2 50 kg de FeTiO 3 .......................... x Kg de TiO 2 x = 26,3 kg 36. Alternativa (E) Assunto: Classificação de cadeias carbônicas I – correta. As duas cadeias possuem o nitrogênio como heteroátomo. II – correta. Na cadeia pentagonal, o nitrogênio apresenta 3 radicais ligados a ele. Na cadeia hexagonal, a função é imida. III – correta. A contagem dos átomos confere com o valor fornecido. 37. Alternativa (D) Assuntos: Isomeria espacial, isomeria óptica, atividade óptica De acordo com a estrutura apresentada, temos dois carbonos quirais assinalados na figura: O número de isômeros opticamente ativos é igual a 2n = 22 = 4. 38. Alternativa (D) Assuntos: Funções orgânicas, isomeria geométrica. I – errada. O composto pertence à função álcool. II – correta. Conforme a figura abaixo: III – correta. A geometria linear do carbono é determinada pela presença das ligações triplas. 39. Alternativa (A) Assunto: Identificação de funções orgânicas Observe as funções presentes na figura abaixo: 40. Alternativa (A) Assuntos: Propriedades físicas dos compostos orgânicos O silicato forma um menor número de ligações de hidrogênio do que o ácido salicílico (grupo carboxila) por isso seu ponto de ebulição é menor. E a maior acidez do ácido salicílico deve-se ao hidrogênio ionizável da carboxila. 41. Alternativa (B) Assunto: Reações Orgânicas I – é uma reação de substituição. Característica de aromáticos e alcanos. II – é uma reação de adição. Característica de alcenos e alcinos. 42. Alternativa (A) Assunto: Teorias modernas de ácido e base – Lewis O alcaloide é uma base de Lewis, pois o nitrogênio possui um par de elétrons não ligantes que é doado (base de Lewis) para o hidrogênio ionizável do ácido fórmico que recebe este par de elétrons. 43. Alternativa (C) Assunto: Concentração de soluções Concentração molar = massa do soluto/ mol do soluto x volume (em litros) Concentração molar = 4,95 . 10-3 / 198 x 0,25 = 1 x 10-4 mol/L 44. Alternativa (E) Assunto: Classificação de soluções Observe que as duas soluções são saturadas à mesma temperatura, portanto mesma concentração. A única diferença entre elas é que a solução II tem precipitado. 45. Alternativa (E) Assuntos: Termoquímica, energia de ligação CH 4 + Cl 2 → CH 3 Cl + HCl ∆H = -25 kcal.mol-1 [(4 . 105)+(58)] - [(3 . 105) + x + (103)] = -25 46. Alternativa (A) Assuntos: Cinética química, gráficos I – correta. A concentração do reagente A ficou constante. Não houve reação. II – errada. A simples observação do gráfico do segundo experimento sugere que a concentração foi diminuindo ao longo do tempo, logo a velocidade também diminuiu. III – errada. Uma reação de primeira ordem é aquela na qual a velocidade é diretamente proporcional à concentração do reagente. A variação da concentração com o tempo para uma cinética de primeira ordem é exponencial. 47. Alternativa (C) Assunto: equilíbrio iônico, pH, pOH I – correta. Se o pH = 8, então a concentração de íons H+ é igual a 10-8; o pOH será 6 e a concentração de íons hidroxila OH- será igual a 10-6. II – errada. pH maior do que 7 é mais básico do que pH menor que 7. III – correta. O CaCO 3 é um sal derivado de uma base forte (Ca(OH) 2 ) e um ácido fraco (H 2 CO 3 ), logo seu caráter é básico. O pH do solo gaúcho irá aumentar. 48. Alternativa (D) Assuntos: Pilhas, células galvânicas, célula a combustível Numa célula a combustível, a oxidação do H 2 ocorre no ânodo e a redução do O 2 ocorre no cátodo. A célula a combustível produz energia, portanto é uma célula galvânica. 49. Alternativa (D) Assuntos: Velocidade das reações, processos endotérmicos e exotérmicos I - errada. A etapa que determina a velocidade da reação é a lenta. II - correta. A entalpia dos reagentes é maior que a entalpia dos produtos, ∆H < 0, reação exotérmica. III – correta. Considerando que a energia de ativação começa nos reagentes e termina no complexo ativado, a etapa 1 apresenta maior valor de energia de ativação. 50. Alternativa (C) Assuntos: Equilíbrio químico, cinética química I – errada. Somente as reações reversíveis atingem o equilíbrio químico. II – errada. O catalisador atua sobre a energia de ativação da reação, diminuindo-a. III – correta. No equilíbrio, as concentrações permanecem constantes.
Download