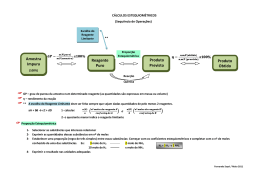
Química Aplicada à Engenharia Ambiental Cálculo Estequiométrico Profa Ana Cláudia Mendes de Seixas Reagente Limitante /Reagente em Excesso 01) O trissulfeto de tetrafósforo, P4S3, é usado na fabricação de fósforo e o e enxofre elementares reagem diretamente para formar P4S3. 8P4 + 3S8 → 8 P4S3 Massa Molar S8 = 256,6 g/mol; P4S3 = 220,1 g/mol a)Se tivermos 153g de S8 e um excesso de fósforo, que massa de P4S3 poderá ser produzida por essa reação? b)Se 28,2g de P4 são deixados reagir com 18,3g de S8, qual é o reagente limitante? Reagente Limitante /Reagente em Excesso 02) Uma solução de HCl(aq) contém 5,22g HCl. Quando ela é deixada reagir com 3,25g de K2CO3, sólido, os produtos são KCl, CO2 e H2O. Qual reagente está em excesso? 2HCl + K2CO3 → 2KCl + CO2 + H2O 03) 10 gramas de gasolina ( supondo que seja octano) queimam com 20 gramas de oxigênio. Considere que a reação só se produz CO2 e H2O. Qual é o reagente limitante? 2C8H18 + 25O2→ 16 CO2 + 18H2O Rendimento Teórico e Percentual 04) O processo de Solvay é importante na produção comercial do carbonato de sódio (Na2CO3) que é usado na fabricação de vidros. A última etapa no processo de Solvay é a conversão do NaHCO3 (bicarbonato de sódio) em Na2CO3 por meio de aquecimento. Os produtos desta reação são: carbonato de sódio, dióxido de carbono e água. 2 NaHCO3 + aquecimento → Na2CO3 + CO2 + H2O Em um experimento de laboratório, um estudante aqueceu 42,0 g de NaHCO3 e determinou que 22,3g de Na2CO3 são formados. Qual é o rendimento percentual dessa reação? Estequiometria de Solução 05) A hidrazina combustível (N2H4) pode ser produzida pela reação das soluções de hipoclorito de sódio e amônia. A reação química relevante é NaClO (aq) + 2 NH3(aq) → N2H4(aq) + NaCl(aq) + H2O a)Se 750 mL de NaClO 0,806 mol/L forem misturados com excesso de amônia, que quantidade de matéria de hidrazina poderá ser formada? Se o volume final da solução resultante for 1,25L qual será a concentração em quantidade de matéria hidrazina? Estequiometria de Solução 06) Muitas titulações comuns envolvem reação de um ácido com uma base. Se 24,75 mL de solução NaOH 0,503 mol/L forem usados para titular uma amostra de 15,0 mL de H2SO4 qual será a concentração do ácido? H2SO4 + 2NaOH → Na2SO4 + 2 H2O
Download