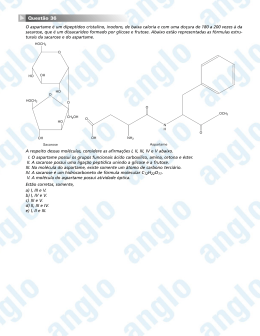
01. (C7H24) Observe a figura e leia o texto a seguir. Adap.: LINHARES, S; GEWANDSZNAJDER, F. "Biologia - programa completo." São Paulo: Ática, 1998. p. 16. Vivendo no interior dos tecidos dos corais, as zooxandelas (algas) estabelecem com os seus anfitriões uma relação de mútua cooperação: geram oxigênio e matéria orgânica que suprem parte das necessidades metabólicas dos corais, e deles recebem compostos nitrogenados, fósforo e gás carbônico para realizar sua fotossíntese... Revista "GALILEU". Número 89, novembro de 1998. No processo de fotossíntese, os vegetais produzem substâncias orgânicas para o organismo e liberam oxigênio na atmosfera. De acordo com a equação química representada na figura, assinale a alternativa correta. a) A planta precisa de 1 mol de gás carbônico para produzir 6 mols de oxigênio. b) O número de moléculas do produto é igual ao número de moléculas dos reagentes. c) O número de átomos presentes nos reagentes é sempre menor que os presentes nos produtos. d) A glicose produzida e armazenada retém um quinto do oxigênio utilizado nesse processo. e) 6 moléculas de H2O são necessárias para cada mol de glicose produzido. RESPOSTA – QUESTÃO 01 6 H2O + 6 CO2 6 O2 + 1 C6H12O6 02. Muita informação errônea vem circulando na internet brasileira sobre bicarbonato de sódio, consistindo num grande desserviço às pessoas que poderiam se beneficiar dos poderes terapeuticos desta substância. Andou circulando um email propagando os benefícios do bicarbonato para a cura do câncer. O problema é que este email, num tom completamente sensacionalista e carecendo de referências científicas, gerou reações negativas de muitas pessoas tanto da área de saúde convencional quanto alternativa, que, sem pesquisar os fatos e se baseando apenas em tal email, passaram a pregar contra o uso do bicarbonato. (http://caminhosparaasaude.blogspot.com.br/2013/03/bicarbonato-de-sodio.html) Sobre o bicarbonato de sódio (NaHCO3), podemos afirmar que: a) Usa-se como antiácido, para tratar a acidez do estômago porque ele tem o poder de neutralizar os excessos do ácido nítrico do suco gátrico. b) É empregado na extinção de pequenas chamas, pelo CO2, resultante da sua decomposição térmica de acordo com a reação: 2NaHCO3 → Na2CO3 + CO2 + H2O c) Na higienização bucal, na forma de bochecho o bicarbonato de sódio atua na neutralização dos ácidos que atacam o esmalte dentário, também para o combate de aftas.Sendo que sua solução aquosa permanece incolor em presença do indicador fenolftaleína. d) Devido à capacidade do bicarbonato de sódio libertar um óxido neutro gasoso, também é muito usado nas receitas de culinária como agente levedante (“fermentos químicos"), para ser utilizado no crescimento das massas de pães, bolos e biscoitos e) A decomposição térmica de um mol do sal produz 22,4litros de CO2 nas CNTP. 2NaHCO3 → Na2CO3 + CO2 + H2O 2 mols DE NaHCO3 ................22,4 litros de CO2 1 mol ........................................ X X = 11,2 LITROS DE CO2 03. (C7H26) (ENEM) Segundo o poeta Carlos Drummond de Andrade, a "água é um projeto de viver". Nada mais correto, se levarmos em conta que toda água com que convivemos carrega, além do puro e simples H2O, muitas outras substâncias nela dissolvidas ou em suspensão. Assim, o ciclo da água, além da própria água, também promove o transporte e a redistribuição de um grande conjunto de substâncias relacionadas à dinâmica da vida. No ciclo da água, a evaporação é um processo muito especial, já que apenas moléculas de H2O passam para o estado gasoso. Desse ponto de vista, umas das conseqüências da evaporação pode ser a) a formação da chuva ácida, em regiões poluídas, a partir de quantidades muito pequenas de substâncias ácidas evaporadas juntamente com a água. b) a perda de sais minerais, no solo que são evaporados juntamente com a água. c) o aumento, nos campos irrigados, da concentração de sais minerais na água presente no solo. d) a perda, nas plantas, de substâncias indispensáveis à manutenção da vida vegetal, por meio da respiração. e) a diminuição, nos oceanos, da salinidade das camadas de água mais próximas da superfície. 04. (C5H17) No gráfico abaixo, temos a relação entre o calor desprendido na combustão total de gás etano (C2H6) e sua massa: (Dados: massas molares em g/mol: C: 12; H: 1.) A partir do gráfico, podemos calcular que o calor de combustão do referido hidrocarboneto é, em kcal/mol, igual a: a) 170 b) 340 c) 510 d) 680 e) 850 C2H6 3g ............. 34 Kcal C = 12 . 2 = 24 H=1 .6= 6 30g ............. X 30g/mol X = 340 Kcal LETRA:B 05. As tatuagens de cores pretas usadas pelos índios, que impressionavam os colonizadores do Brasil, eram feitas utilizando a seiva do fruto do jenipapo, Genipa americana. Essa pigmentação devia-se à ação do iridóide, conhecido como genipina. Na estrutura da genipina, são encontrados grupamentos funcionais característicos das funções: CO2H a) aldeído e éster. b) aldeído e álcool. c) ácido carboxílico e álcool. d) ácido carboxílico e éster. e) aldeído e ácido carboxílico. O OH Genipina CH2O H 06. (C7H24) Um processo laboratorial para conversão de alcenos em cetonas de mesma cadeia carbônica consiste na prévia conversão do alceno (I) em álcool (II), etapa A, e posterior conversão deste último na cetona (III), etapa B, conforme o esquema a seguir: As reações utilizadas para essas duas conversões devem ser, respectivamente: a) Oxidação de I e redução de II. b) Hidratação de I e redução de II. c) Redução de I e hidrogenação de II. d) Hidratação de I e oxidação de II e) Hidrogenação de I e oxidação de II. 07. (C7H26) Julgue os itens abaixo colocando verdadeiro ou falso ( ) O alcatrão da hulha obtido através da destilação seca da hulha constitui-se numa excelente fonte de composto aromático para industria petroquímica ( ) Tanto o Metil-Terc-Butil-Eter (MTBE) quanto o Chumbo Tretaetila-Pb(C2H5)4 são considerados antidetonantes da gasolina, bastante utilizados atualmente no Brasil. ( ) O petróleo de base naftênica é de superior qualidade ao de base parafínica. ( ) O petróleo é uma substância originada a partir do soterramento de animais e vegetais ocorridos há milhares de anos. 08. (ENEM) Cerca de 1% do lixo urbano é constituído por resíduos sólidos contendo elementos tóxicos. Entre esses elementos estão metais pesados como o cádmio, o chumbo e o mercúrio, componentes de pilhas e baterias, que são perigosos à saúde humana e ao meio ambiente. Quando descartadas em lixos comuns, pilhas e baterias, vão para aterros sanitários ou lixões a céu aberto, e o vazamento de seus componentes contamina o solo, os rios e o lençol freático, atingindo a flora e a fauna. Por serem bioacumulativos e não biodegradáveis, esses metais chegam de forma acumulada aos seres humanos, por meio da cadeia alimentar. A legislação vigente (Resolução CONAMA no 257/1999) regulamenta o destino de pilhas e baterias após seu esgotamento energético e determina aos fabricantes e/ou importadores a quantidade máxima permitida desses metais em cada tipo de pilha/bateria,porém o problema ainda persiste. Disponível em: http://www.mma.gov.br. Acesso em: 11 jul. 2009 (adaptado). Uma medida que poderia contribuir para acabar definitivamente com o problema da poluição ambiental por metais pesados relatado no texto seria: a) deixar de consumir aparelhos elétricos que utilizem pilha ou bateria como fonte de energia. b) usar apenas pilhas ou baterias recarregáveis e de vida útil longa e evitar ingerir alimentos contaminados, especialmente peixes. c) devolver pilhas e baterias, após o esgotamento da energia armazenada, à rede de assistência técnica especializada para repasse a fabricantes e/ou importadores. d) criar nas cidades, especialmente naquelas com mais de 100 mil habitantes, pontos estratégicos de coleta de baterias e pilhas, para posterior repasse a fabricantes e/ou importadores. e) exigir que fabricantes invistam em pesquisa para a substituição desses metais tóxicos por substâncias menos nocivas ao homem e ao ambiente, e que não sejam bioacumulativas. 08.A obtenção de etanol a partir de sacarose por fermentação, pode ser representada pela seguinte equação: C12H22O11 + → 4C2H5OH + 4CO2 Considerando que o etanol (C2H5OH) seja puro, calcule a massa (em Kg) de sacarose necessária para produzir um volume de 50 litros de etanol, suficiente para encher o tanque de um automóvel. Dados: Densidade do etanol = 0,8g/cm3 Massa molar do etanol = 46g/mol Massa molar da sacarose = 342g/mol a) 74,3 Kg de sacarose b) 86,4 Kg de sacarose c) 92,4 Kg de sacarose d) 96,2 Kg de sacarose e) 102 Kg de sacarose I- 1cm3 .......... 0,8g 1000cm3...... X II – 1 litro etanol .......... 800g 50 litros ................. Y X = 800g de etanol Y = 40.000g = 40Kg 1C12H22O11 + H2O 1mol → 4C2H5OH + 4CO2 4mols 342g ..............................4 x 46g X ..............................40Kg X = 342g . 40Kg X = 74,3Kg de sacarose 4 . 46g LETRA: A EU VOU PASSAR!!! Nós que fazemos o estamos muito satisfeitos de termos conseguido conquistar a sua confiança, e é essa confiança que nos motiva a prosseguir nesta caminhada árdua, no entanto, gratificante. Temos absoluta certeza de que a sua vitória depende principalmente da sua vontade de vencer; contamos com ela neste Vestibular, pois, o nosso sucesso enquanto escola é motivado pelo seu, então, acredite em você, seja um Vencedor. Prof. Jurandir. EU VOU PASSAR!!! Não esqueçam: “Tudo posso Naquele que me fortalece” Que Deus ilumine VOCÊS rumo a sua aprovação. REVISÕES PARA VESTIBULARES Prof. Jurandir
Download