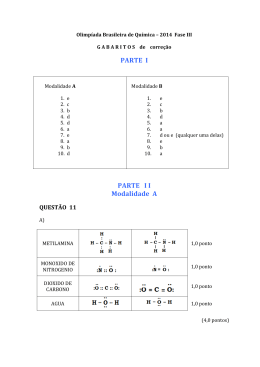
AULA ON-LINE QUÍMICA PROFESSOR JURA CÁLCULOS ESTEQUIOMÉTRICOS Passos básicos para resolução de exercícios que envolvem cálculos estequiométricos: Montar a equação química da reação enunciada e acertar corretamente seus coeficientes estequiométricos. Estabelecer as relações, em mols, das substâncias envolvidas. Identificar as substâncias envolvidas em suas respectivas grandezas (massa, volume, nº de moléculas...) Excluir as substâncias não envolvidas para efeito de cálculo. Substituir a grandeza mol pela grandeza identificada para cada substância. Calcular o que se deseja por regra de três simples. REAÇÃO DE SÍNTESE DA AMÔNIA (Processo Haber - Bosch) N2 + 3.H2 2.NH3 Determine a massa de gás nitrogênio (N2) necessária para produzir 22,4 litros de gás amônia (NH3), nas Condições Normais de Temperatura e Pressão (CNTP) ? N2 + 3.H2 2.NH3 OS CÁLCULOS ESTEQUIOMÉTRICOS NOS VESTIBULARES (FATEC – SP - 2010) - Faculdade de Tecnologia de São Paulo O “cheiro forte” da urina humana deve-se principalmente à amônia, formada pela reação química que ocorre entre ureia, CO(NH2)2 , e água: CO(NH2)2(aq) + H2O(ℓ) → CO2(g) + 2.NH3(g) O volume de amônia, medido nas CATP (Condições Ambiente de Temperatura e Pressão), formado quando 6,0 g de ureia reagem completamente com água é, em litros,: Dados: Volume molar nas CATP = 25 L. mol–1 Massas molares, em g . mol–1 : C = 12; H = 1; O = 16; N = 14 A) 0,5 B) 1,0 C)1,5 D) 2,0 E) 5,0 CO(NH2)2(aq) + H2O(ℓ) → CO2(g) + 2.NH3(g) (USP – SP – 2010) – Universidade de São Paulo Sob condições adequadas, selênio (Se) e estanho (Sn) podem reagir, como representado pela equação: 2.Se + Sn → SnSe2 Em um experimento, deseja-se que haja reação completa, isto é, que os dois reagentes sejam totalmente consumidos. Sabendo-se que a massa molar do selênio (Se) é 2/3 da massa molar do estanho (Sn), a razão entre a massa de selênio e a massa de estanho (mSe : mSn), na reação, deve ser de: a) 2 : 1 b) 3 : 2 c) 4 : 3 d) 2 : 3 e) 1 : 2 2.Se + Sn → SnSe2 REAÇÕES CONSECUTIVAS Nas reações consecutivas, o produto da primeira equação aparecerá como reagente da próxima equação. Para fins de cálculo, transformar as equações consecutivas em uma única equação global. (UNESP – SP – 2008) – Universidade Estadual Paulista Estudos recentes indicam que as águas do aquífero Guarani (um dos maiores reservatórios subterrâneos de água doce conhecidos no planeta) estão sendo contaminadas. O teor de nitrogênio já atinge, em determinados locais, valores acima do nível de tolerância do organismo humano. Em adultos, o nitrogênio, na forma de nitrito, atua na produção de nitrosaminas e nitrosamidas, com elevado poder cancerígeno. Considerando as equações químicas a seguir, NO2(aq) + H +(aq) → HNO2(aq) (produção do ácido nitroso no estômago) HNO2(aq) + (CH3)2 NH(aq) → (CH3)2 NNO(aq) + H2O(l) (produção da nitrosamina) Determine a massa da nitrosamina que pode ser produzida a partir de um litro de água cujo teor em nitrito seja igual a 9,2 mg. Apresente seus cálculos. Massas molares, em g/mol: NO2 = 46 e (CH3)2 NNO = 74. NO2(aq) + H +(aq) → HNO2(aq) HNO2(aq) + (CH3)2 NH(aq) → (CH3)2 NNO(aq) + H2O(l) NO2-(aq) + H +(aq) + (CH3)2 NH(aq) → (CH3)2 NNO(aq) + H2O(l) REAGENTE EM EXCESSO E LIMITANTE Nas reações que envolvem reagentes em excesso, deve-se identificar qual substância está em excesso.Uma vez identificada,o cálculo estequiométrico é feito tendo o reagente limitante como referência. (UNICAMP – SP) – Universidade Estadual de Campinas Um dos usos do hidrogênio (H2) é como combustível. Sua reação com o oxigênio (O2) forma água (H2O), como produto único. Num recipiente foram inicialmente colocados 1,0 mol de hidrogênio e 1,0 mol de oxigênio. A reação entre os dois foi provocada por meio de uma faísca elétrica. a) Escreva a equação química que representa a reação entre o hidrogênio e o oxigênio. b) Determine a quantidade (em mol) de cada uma das substâncias restantes no recipiente, após a reação. 2.H2 + 1.O2 → 2.H2O PUREZA Nas reações de reagentes impuros, deve-se desconsiderar as impurezas para efeito de cálculo, identificando,primeiramente, a pureza da amostra reagente. A partir daí, determina-se o que se pede através dos cálculos estequiométricos. (UNIFESP – SP – 2008) – Universidade Federal de São Paulo A geração de lixo é inerente à nossa existência, mas a destinação do lixo deve ser motivo de preocupação de todos. Uma forma de diminuir a grande produção de lixo é aplicar os três R (Reduzir, Reutilizar e Reciclar). Dentro desta premissa, o Brasil lidera a reciclagem do alumínio, permitindo economia de 95 % no consumo de energia e redução na extração da bauxita, já que para cada kg de alumínio são necessários 5 kg de bauxita. A porcentagem do óxido de alumínio (Al2O3) extraído da bauxita para produção de alumínio é aproximadamente igual a: a) 20,0 %. b) 25,0 %. 1.Al2O3 → 2.Al + 3/2.O2 c) 37,8 %. d) 42,7 %. e) 52,9 %. RENDIMENTO Nas reações que envolvem rendimento de processo, deve-se proceder os cálculos padrões da estequiometria. Os dados encontrados, inicialmente, estarão sempre para 100%. A partir daí, calcula-se o rendimento da reação desejada por regra de três simples. (UEM – PR) – Universidade Estadual de Maringá Para produzir ácido fosfórico e monóxido de mononitrogênio, fez-se reagir completamente 0,25g de fósforo vermelho (P) com ácido nítrico concentrado e algumas gotas de água de acordo com a equação: 3.P + 5.HNO3 + 2.H2O → 3.H3PO4 + 5.NO A massa de ácido fosfórico obtida foi de 0,49g. O rendimento do processo foi de: Dados: P = 31; O = 16; H = 1 a) 62 %. b) 13 %. c) 54 %. d) 31 %. e) 87 %. 3.P + 5.HNO3 + 2.H2O 3.H3PO4 + 5.NO MENSAGEM FINAL “Quando você quer alguma coisa, todo o universo conspira para que você realize o seu desejo.” Paulo Coelho Empenham-se em seus estudos e muito sucesso!!! CONTATOS PARA DÚVIDAS E SUGESTÕES jurandir_ [email protected] MUITO OBRIGADO PELA ATENÇÃO DE TODOS!!!!