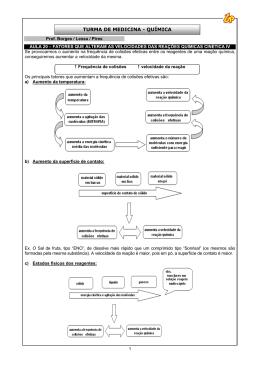
I. INTRODUÇÃO É à parte da química que estuda a maior ou menor rapidez com que uma reação química ocorre e os fatores que a influenciam. Este estudo é importante para o nosso dia-a-dia, pois explica alguns fenômenos que convivemos tais como oxidação do ferro (ocorre de forma lenta), alimentos em panela de pressão cozinham mais rápidos, etc. estas reações podem ter suas velocidades alteradas. Reagentes São consumidos Suas concentrações diminuem Velocidade de consumo Produtos São formados Suas concentrações aumentam Velocidade de formação II. RAPIDEZ (VELOCIDADE) MÉDIA DE UMA REAÇÃO A maior ou menor rapidez (velocidade) com que uma reação ocorre é calculada pela relação entre a quantidade de um reagente (ou produto) que é consumido (ou produzido) e o intervalo de tempo gasto para isto. Normalmente esta velocidade é uma velocidade média. As quantidades das substâncias são medidas em mol/L, massas, volumes (gases), etc. enquanto que o intervalo de tempo pode ser dado em segundos, minutos ou horas. A quantidade de reagente ou produto medida em mol/L é representada por [ ]. A velocidade média é expressa então: aA + bB cC Velocidade de consumo do reagente A: VmA = – [A] t Velocidade de consumo do reagente B: VmB = – [B] t Velocidade de formação do produto C: VmC = [C] t OBS1: O sinal negativo na expressão da velocidade de consumo dos reagentes indica que suas concentrações estão sendo diminuídas, deste modo evitando que a velocidade tenha sinal negativo. Velocidade média da Reação (Vm): Para calcularmos a velocidade média de uma reação, basta dividirmos a velocidade média de consumo ou formação pelo coeficiente estequiométrico. No caso da reação anterior, temos: Vm = VmA a = VmB b Exercício1: O gráfico a seguir representa a variação das concentrações das substâncias X, Y e Z durante a reação em que elas tomam parte. A equação que representa a reação é: a) X + Z → Y b) X + Y → Z c) X → Y + Z d) Y → X + Z e) Z → X + Y Exercício2: Na reação abaixo equacionada, observou-se a variação na concentração de X em função do tempo, segundo a tabela a seguir: X + 2Y → Z Tempo (min.) 0 2 4 6 8 [X] (mol/L) 0,255 0,220 0,200 0,190 0,100 No intervalo de 4 a 6 minutos, a velocidade média da reação em mol/litro.min., é: a) 0,010 d) 0,100 b) 0,255 e) 0,200 c) 0,005 Exercício3: A combustão da gasolina pode ser equacionada por: C8H18 + O2 CO2 + H2O Considere que após uma hora e meia de reação foram produzidos 36 mols de CO2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por minuto, é de: a) 3,0 d) 0,4 b) 4,5 e) 0,05 c) 0,1 Exercício4: A amônia é empregada como matéria-prima na fabricação de fertilizantes nitrogenados. É obtida industrialmente por síntese total, como mostra a reação: N2(g) + 3H2(g) → 2NH3(g) O quadro a seguir mostra a variação do número de mols de nitrogênio durante essa reação. Considere rendimento de 100% no processo e condições normais de temperatura e pressão. Assim, a velocidade média da reação em L/min, no intervalo de 2 a 10 minutos, em função do consumo de H2, equivale a: a) 22,4 b) 44,8 c) 67,2 d) 89,6 e) 69,3 III. COMO ACONTENCEM AS REAÇÕES QUÍMICAS? TEORIA DAS COLISÕES: Uma reação química ocorre através das colisões entre as substâncias reagentes. Mas essa colisão não pode ser um simples contato entre as moléculas. Para garantir a ocorrência da reação, temos que ter a colisão eficaz ou efetiva, entre os reagentes. = VmC c www.profkemil.ning.com 1 OBS2: Colisão eficaz ou efetiva é a colisão que provoca a formação dos produtos. De acordo com a teoria das colisões pode-se afirmar que a velocidade de uma reação depende: Da frequência das colisões. Da energia das colisões. Da orientação das moléculas nas colisões. ENERGIA DE ATIVAÇÃO (Ea): para que as moléculas quebrem suas ligações iniciais e formem novas substâncias é necessária uma energia mínima denominada de ENERGIA DE ATIVAÇÃO (Ea). Energia de ativação é a menor quantidade de energia necessária que deve ser fornecida aos reagentes para a formação do COMPLEXO ATIVADO e, em consequência, para a ocorrência da reação. Eletricidade. Luz. Pressão. Catalisadores. Concentração dos reagentes. a) Estado de agregação em que se encontram os reagentes. Como as reações químicas dependem da frequência dos choques efetivos entre as moléculas dos reagentes, em geral, os gases por apresentar suas moléculas em constante movimento desordenado, reagem mais rapidamente que os líquidos, e estes mais rapidamente que os sólidos. Gasoso > Líquido > Sólido Velocidade b) Superfície de Contato de um Reagente Sólido. Quanto maior a superfície do reagente sólido, maior o número de colisões entre as partículas dos reagentes e maior a velocidade da reação. Uma reação que ocorre com a presença de pelo menos um reagente sólido, quanto mais finamente dividido este sólido, maior será a superfície de contato entre os reagentes. c) Temperatura em que se realiza a reação: um aumento da temperatura aumenta a frequência e a energia das colisões entre os reagentes, como consequência, o número de colisões efetivas e a velocidade da reação aumentam. Assim, foi enunciada a Lei de Vant’ Hoff: a cada aumento de 10oC na temperatura de uma reação a sua velocidade duplica em geral. 20°C ---------- V 30°C --------- 2V 40°C --------- 4V d) Eletricidade: A energia elétrica pode ser usada para aumentar a energia cinética das moléculas e, em função disto aumentar a velocidade da reação. É o que ocorre nos motores dos automóveis onde a faísca elétrica provoca a combustão da gasolina. e) Luz: A luz provoca algumas reações denominadas de REAÇÕES FOTOQUÍMICAS. As principais são: Fotossíntese, decomposição da água oxigenada em água e oxigênio. f) Pressão: Em reações gasosas, quanto maior for a pressão maior será a velocidade da reação química. A frequência e a energia das colisões são afetadas pelos fatores: Estado de agregação em que se encontram os reagentes. Superfície de Contato de um reagente sólido. Temperatura em que se realiza a reação. www.profkemil.ning.com 2 g) Catalisadores: É uma substância que diminui a energia de ativação de uma reação aumentando assim a sua velocidade. Os catalisadores não são consumidos durante a reação. OBS3: O catalisador não altera o H da reação. OBS4: A energia de ativação (Ea) é sempre igual à diferença entre a energia dos reagentes e a do complexo ativado. Inibidor ou Catalisador negativo: é uma substância que diminui a velocidade de uma reação, sendo, ao contrário do catalisador, consumido pela reação. Os inibidores são muito utilizados na conservação de alimentos, bebidas e outros produtos perecíveis. Autocatálise: Quando um dos produtos da reação atua como catalisador. No início, a reação é lenta e, à medida que o catalisador (produto) vai se formando, sua velocidade vai aumentando. Exercício5: O carvão é combustível constituído de uma mistura de compostos ricos em carbono. A situação do combustível, do comburente e a temperatura utilizada favorecerão a combustão do carbono com maior velocidade é, respectivamente: a) carvão em pedaços, ar atmosférico, 0°C. b) carvão pulverizado, ar atmosférico, 30°C. c) carvão em pedaços, oxigênio puro, 20°C. d) carvão pulverizado, oxigênio puro, 100°C. e) carvão em pedaços, oxigênio líquido, 50°C. Exercício6: Para que ocorra uma reação química, é necessário que os reagentes entrem em contato, através de colisões, o que se chama Teoria das Colisões. Essa teoria baseia-se em que: I - todas as colisões entre os reagentes são efetivas (ou favoráveis). II - a velocidade da reação é diretamente proporcional ao número de colisões efetivas (ou favoráveis). III - existem colisões que não são favoráveis à formação do produto. IV - maior será a velocidade de reação, quanto maior for a temperatura. Estão corretas a) apenas I, II e III. d) apenas II, III e IV. b) apenas II e III. e) apenas III e IV. c) apenas I e IV. Exercício7: Considere as seguintes afirmativas em relação ao gráfico de uma reação: TIPOS DE REAÇÃO COM CATALISADOR: CATÁLISE HETEROGÊNEA: Catálise Heterogênea é aquela em que o catalisador e os reagentes estão em fases diferentes, formando um sistema heterogêneo. Ex1: Pt C2H4(g) + H2(g) C2H6(g) CATÁLISE HOMOGÊNEA: Catálise Homogênea é aquela em que o catalisador e os reagentes estão numa mesma fase, formando um sistema homogêneo. Ex2: NO2 SO2(g) + ½O2(g) SO3(g) Promotor de reação ou ativador de catalisador: é uma substância que ativa o catalisador, mais isoladamente não tem ação catalítica na reação. Veneno de catalisador: é uma substância que diminui e até destrói a ação do catalisador, sem tomar parte na reação. I - Z representa a energia de ativação na presença de catalisador. II - Y representa a energia de ativação na presença de catalisador. III - X representa a variação de entalpia. IV - A velocidade de formação dos produtos é menor no caminho B. As afirmações anteriores referem-se ao diagrama energético dos caminhos A e B da reação: Somente são corretas: a) I e III. d) III e IV. b) II e III. e) I e IV. c) II e IV. www.profkemil.ning.com 3 h) CONCENTRAÇÃO DE REAGENTES: Aumentando a concentração dos reagentes, aumenta o número de colisões entre as moléculas dos reagentes e, portanto, aumenta a velocidade da reação. V = [Reagentes] Para uma reação genérica: a A + b B Produtos, A velocidade da reação é dada pela expressão: V = K [A]X [B]Y Onde os valores de “x” e “y” são determinados experimentalmente. Esta equação é conhecida pelo nome de LEI DA VELOCIDADE. Vários cientistas tentaram estabelecer uma relação matemática entre a velocidade da reação e a concentração, entretanto, foram Guldberg e Waage, em 1867, que enunciaram a lei que relaciona essas duas grandezas, a qual recebeu o nome da Lei da Ação das Massas. Para as reações elementares os valores dos expoentes são iguais aos coeficientes das substâncias na equação química. Na reação 2 NO(g) + H2(g) N2O(g) + H2O(g) a equação da velocidade é V = K.[NO]2.[H2]. ORDEM DE UMA REAÇÃO: Os expoentes da equação da velocidade caracterizam a ordem da reação. Assim, no exemplo: A reação é de 3ª ordem (2 + 1 = 3). Em relação ao NO, a reação é de 2ª ordem. Em relação ao H2, a reação é de 1ª ordem. Se uma reação ocorrer em várias etapas sua velocidade é dada pela etapa mais lenta. A + A A2 A2 + B A2B (etapa lenta) (etapa rápida) 2 A + B A2B (reação global) A velocidade desta reação será dada por: V = k . [A]2 MOLECULARIDADE: é o número de moléculas que se chocam em cada reação elementar. Portanto, para o exemplo anterior a molecularidade é 3. # IPC: - Sólidos e líquidos puros não entram na expressão da velocidade; - Os expoentes determinam a ordem da reação química e mostra como a velocidade varia com a concentração dos reagentes; - Para reações em várias etapas é a etapa lenta que determina a lei da velocidade. Exercício8: A reação A + 2 B P se processa em uma única etapa. Qual a velocidade desta reação quando K = 0,3 L/mol.min, [A] = 2,0 M e [B] = 3,0 M ? a) 5,4. d) 18,0. b) 4,5. e) 54. c) 1,8. Exercício9: Na decomposição térmica da amônia expressa pela equação: 2 NH3(g) N2(g) + 3 H2(g) Duplicando-se a concentração molar de NH3, a velocidade da reação ficará: a) inalterada. d) quatro vezes maior. b) duas vezes maior. e) seis vezes maior. c) três vezes maior. Exercício10: Considerando a reação: NO2(g) + CO(g) NO(g) + CO2(g) que ocorre em uma única etapa e que, numa dada temperatura, apresenta a lei experimental de velocidade dada por v = k.[NO2].[CO], é correto afirmar que essa reação é de: a) 3ª ordem e molecularidade 2. b) 2ª ordem e molecularidade 3. c) 3ª ordem e molecularidade 3. d) 2ª ordem e molecularidade 2. e) 5ª ordem e molecularidade 5. Exercício11: Para uma reação elementar do tipo: A + 2 B C, Pode-se afirmar que: a) A velocidade de consumo de A é igual à velocidade de formação de C. b) A velocidade de consumo de B é a metade da velocidade de formação de C. c) A soma das velocidades de consumo de A e B é igual à velocidade de formação de C. d) A velocidade da reação é dada pela relação v = k.[A].[B]. e) A reação de segunda ordem. Exercício12: A combustão do butano (C4H10) corresponde à equação: C4H10 + ⁄ O2 4CO2 + 5 H2O + energia Se a velocidade da reação for 0,05 mol de butano por minuto, qual será a massa de CO2 produzida em 1 hora? Dados: C = 12 g/mol; O = 16 g/mol; H = 1 g/mol. a) 880g. d) 528g. b) 264g. e) 132g. c) 8,8g. Exercício13: A função dos conversores catalíticos automotores é absorver moléculas de gases poluentes e, através de um processo chamado catálise, oxidar ou decompor esses gases, como mostra o exemplo abaixo. Para a reação global: 2 NO(g) + O2(g) 2 NO2(g) Na qual NO2 atmosférico é gerado a partir de NO expelido dos escapamentos de automóveis, é proposto o seguinte mecanismo, em duas etapas: 1ª Etapa: 2 NO(g) N2O2(g) (etapa rápida) 2ª Etapa: N2O2(g) + O2(g) 2 NO2 (g) (etapa lenta) Considerando o mecanismo descrito acima a Lei da Velocidade será: a) v = k[NO] [O2]. d) v = k[NO]4 [O2]2. 2 b) v = k[NO] [O2]. e) v = k[NO]2 [H2]5 c) v = k[N2O2].[O2] www.profkemil.ning.com 4 # Exercícios envolvendo Experimentos: Exercício14 (Resolvido): Para a reação de decomposição do N2O5, foram obtidos os seguintes valores experimentais: 2N2O5 4NO2 + O2 V Experimento [N2O5] 1 2 3 0,010 0,020 0,030 (mol/L.h) 0,016 0,032 0,048 Analisando os valores da tabela acima, encontre a lei de velocidade para a reação de decomposição do N2O5: 1º Passo: Escrever a lei de velocidade literalmente, ou seja, adote variáveis para os expoentes. V = k.[N2O5]x 2º Passo: Encontrar o valor do expoente dividindo a equação da lei da velocidade do experimento 2 pela do experimento 1. V2 = k2.[ N2O5]2x 0,032 = k2.[0,02]x V1 = k1.[N2O5]1x 0,016 = k1.[0,01]x 2 = 2x 21 = 2x 1=x Logo: V = k.[N2O5] 1 ou V = k.[N2O5] Exercício15 (Resolvido): Para a reação entre H2 e NO foram obtidos os seguintes valores experimentais: 2H2 + 2NO N2 + 2 H2O Experimento [H2] [NO] V (mol/L.h) 1 0,001 0,001 3.10-5 2 0,002 0,001 6.10-5 3 0,002 0,002 24.10-5 A equação de velocidade desse processo é: 1º Passo: Escrever a lei de velocidade literalmente, ou seja, adote variáveis para os expoentes. V = k.[H2]x.[NO]y 2º Passo: Encontrar o valor dos expoentes dividindo a equação da lei da velocidade do experimento 2 pela do experimento 1 e do experimento 3 pela do experimento 2. -Para o expoente x: V2 = k2. [H2]2x.[NO]2y 6.10-5 = k2.[0,002]x.[0,001]y V1 = k1. [H2]1x.[NO]1y 3.10-5 = k1.[0,001]x.[0,001]y 2 = 2x 1=x -Para o expoente y: V3 = k3. [H2]3x.[NO]3y 24.10-5 = k3.[0,002]x.[0,002]y V2 = k2. [H2]2x.[NO]2y 6.10-5 = k2.[0,002]x.[0,001]y 4 = 2y 22 = 2y 2=y 1 2 Logo: V = k.[H2] .[NO] ou V = k.[H2].[NO]2 Exercício16: Os dados experimentais para a velocidade de reação, (V), indicados no quadro a seguir: Foram obtidos a partir dos resultados em diferentes concentrações de reagentes iniciais para a combustão do monóxido de carbono em temperatura constante: CO + ½ O2 CO2 A equação de velocidade para essa reação pode ser escrita como V=k[CO]a.[O2]b, onde a e b são, respectivamente, as ordens de reação em relação aos componentes CO e O2. De acordo com os dados experimentais, é correto afirmar que respectivamente os valores de a e b são: a) 1 e 2 c) 3 e 2 e) 1 e 1 b) 2 e 1 d) 0 e 1 Exercício17: A tabela abaixo apresenta os valores das velocidades de reação e as correspondentes concentrações em mol/L dos reagentes em idênticas condições, para o processo químico representado pela equação: 3X + 2Y Z + 5W A equação de velocidade desse processo é: a) v = k [X]3 [Y]2. d) v = k [X]2 [Y]0. 2 2 b) v = k [X] [Y] . e) v = k [X]2 [Y]3. 0 2 c) v = k [X] [Y] . Exercício18: Num laboratório foram efetuadas diversas experiências para a reação: 2 H2(g) + 2 NO(g) N2(g) + 2 H2O(g) Com os resultados das velocidades iniciais obtidos, montou-se a seguinte tabela: Baseando-se na tabela anterior, podemos afirmar que a lei de velocidade para a reação é: a) v = k. [H2]. b) v = k. [NO]. c) v = k. [H2].[NO]. 2 d) v = k. [H2] .[NO]. 2 e) v = k. [H2].[NO] . Exercício19: A ação anestésica do clorofórmio (CHCl3) dáse por esse ser muito volátil. Dessa forma, ele absorve calor da pele, a qual tem temperatura diminuída, então os nervos sensitivos, que mandam as informações ao cérebro, ficam inativos e a sensação de dor e diminuída. A tabela a seguir apresenta os dados de três experimentos da reação química dada por: CHCl3(g) + Cl2(g) CCl4(g) + HCl(g) Usando esses dados, assinale o correto. a) A lei da velocidade é: v = k[CHCl3][Cl2]. b) A reação é de segunda ordem em relação ao clorofórmio. c) O valor da constante de velocidade é 5.103 L/mol.min. d) A reação é de ordem três meios ( ⁄ ) em relação ao cloro. e) A reação é de quarta ordem em relação ao cloro. www.profkemil.ning.com 5
Download