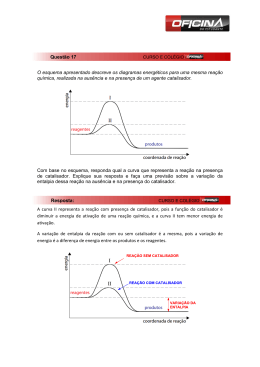
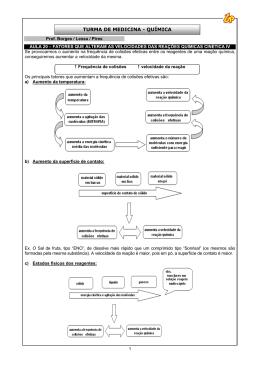
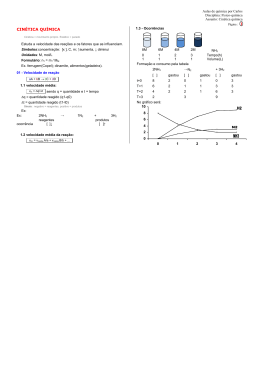
Profª. Norilda Siqueira de Oliveira www.norildasiqueira.wikispaces.com Toda reação química necessita de um certo tempo para se completar. Reação de neutralização.(reação muito rápida). H2SO4 + NaOH→ Na2SO4 + H2O Formação da H2O H2 + ½ O2 → H2O Transformação de gases tóxicos em não-tóxicos. (Condições ambiente lenta, mas em ( pode ficar anos sem ocorrer, mas uma faísca desencadeará uma reação explosiva). condições adequada pode ser usada para diminuir a poluição emitida pelos automóveis). 2 CO + 2 NO →2 CO2 + N2 Panela de pressão p/ acelerar o cozimento. Geladeira para retardar a decomposição dos alimentos. Pintura para retardar a oxidação (ferrugem). NaN3 → 2 Na + 3N2 10 Na + 2 KNO3 → K2O + 5 Na2O + N2 K2O + Na2O + SiO2 → silicato alcalino 0,8 segundo Cinética química (cinética vem do grego kinetiké, significa “movimento”). Esse ramo da ciência se preocupa em estudar a rapidez das reações químicas e os fatores que a influenciam. Complexo ativado é o estado intermediário formado entre reagente e produtos, em cujas estruturas existem ligações enfraquecidas(reagentes) e formação de novas ligações(produtos). E1= energia dos reagentes (r) E2= energia do complexo ativado (CA) E3= energia dos produtos (p) b=energia de ativação da reação direta c=variação de entalpia (∆H= Hp – Hr) A velocidade de uma reação, se trata da velocidade com que um reagente está sendo consumido ou com que um produto está sendo formado num intervalo de tempo. Velocidade média = quantidade tem po 2 NH3 → N2 + 3H2 Concentração de NH3 (mol.L-1) Tempo (h) HCℓ 8,0 4,0 2,0 1,0 00 2,0 3,0 1,0 H2O2(L) → H2O(L) + O2(g) Área de contato entre os reagente; Concentração dos reagente; Temperatura e energia de ativação; Ação de catalisadores. Esse fator tem sentido quando um dos reagentes for sólido.( batata, estômago) Fe(prego) + H2SO4(aq) → FeSO4 (aq) + H2(g) V1 Fe(limalha) + H2SO4(aq) → FeSO4 (aq) + H2(g) V2 Na segunda reação a área de contato é maior. Portanto V2 › V1 O O2 é o responsável pela deterioração do suco de laranja.Dentro da laranja a [ ] de O2 é baixa e o suco dura alguns dias, mas fora aumentando a [ ] de O2 e o suco estraga muito rápido. Quanto maior a concentração dos reagentes, maior será a velocidades da reação. O carvão na churrasqueira quando abanado fica incandescente porque estamos aumentando a [ ] de gás oxigênio (O2 , que é reagente na combustão), portanto aumenta a velocidade da reação. ↑TEMPERATURA ↑ ENERGIA CINÉTICA ↑ COLISÃO ↑ VELOCIDADE Regra de Van’t Hoff: um aumento em 10ºC provoca uma duplicação na velocidade da reação. Os alimentos gelados estragam com menor facilidade, pois a velocidade da reação diminui. Os incêndios se alastram rápido porque a energia liberada pela combustão (exotérmica)ajuda as moléculas que ainda não reagiram a vencer as barreiras energéticas que separa reagentes e produtos. Todo ser vivo depende do conjunto de reações químicas que acontecem no corpo, chamado de metabolismo. Hipertermia, aumento da temperatura corporal, aumenta o metabolismo aumentando assim o consumo de oxigênio e glicose. A febre é uma defesa contra vírus e bactérias. Temperaturas acima de 41,7°C pode causar a morte pois destroem substâncias vitais, as enzimas. Hipotermia, diminuição da temperatura corporal. Abaixo de 30°C a pessoa pode morrer, pois as reações químicas vitais não ocorrem. O uso controlado da hipotermia é usada pelos médicos nas cirurgias. Pois diminui o consumo de O2 do coração ou do cérebro e reduz a chance de danos causados pela circulação sanguínea, inevitável em alguns procedimentos cirúrgicos. È a energia mínima necessária para ativar as moléculas fazendo com que elas colidam efetivamente, possibilitando o início da reação. Além de colisões com orientação espacial adequada, as moléculas devem apresentar uma energia cinética mínima que propicie uma ruptura das ligações entre os reagentes e formação de novas ligações, nos produtos. Quanto maior a energia de ativação, mais lenta é a reação. Quanto maior a Ea, mais lenta é a reação. C.A.= Complexo ativado. Ea = Energia de ativação. HR. = Entalpia dos reagentes. HP. = Entalpia dos produtos. ∆H = Variação de entalpia. As variações de temperatura modificam o valor da constante de velocidade (K). Um aumento da T aumenta a frequências das colisões intermoleculares e aumenta a energia cinética das moléculas fazendo com que um maior número alcance a energia de ativação. Um aumento na energia cinética (agitação das moléculas) favorece a ruptura das ligações. Entende-se por catálise toda e qualquer reação que ocorre com a presença de um catalisador. Catálise homogênea: o catalisador e os reagentes constituem uma única fase. Catálise heterogênea: o catalisador e reagentes constituem mais de uma fase. O catalisador é uma substância que aumenta a velocidade da reação, sem ser consumida durante tal processo. Os catalisadores encontram caminhos alternativos para a reação, envolvendo menor energia.(diminuem a Ea, tornando-a mais rápida). Somente aumentam a velocidades; Não são consumidos; Não iniciam reação, mas interferem nas que já ocorreram sem sua presença; Podem ser usados em pequenas quantidades; Seus efeitos podem ser diminuídos pela presença de “venenos de catálise”. SO2(g) + ½ O2(g) →SO3(g) Ea=+ 240 KJ.mol-1 sem catalisador Utilizando o NO2(g) como catalisador a Ea se reduz para 110 KJ.mol-1, tornado a reação extremamente mais rápida. Mecanismo da reação SO2 + NO2 →SO3 + NO NO + ½ O2 → NO2 SO2 + ½ O2 →SO3 E1 consumo do catalisador E2 regeneração do catalisador Equação global Ea= +110 KJ.mol-1 Inibidor: é uma substância que retarda a velocidade da reação. Veneno: é uma substância que anula o efeito de um catalisador. A velocidade é proporcional a concentração dos reagentes. Esse fator é expresso pela Lei da Ação das massas ou Lei Cinética. (Gulberg e Waage) V = k [A]a. [B]b V = velocidade da reação; [ ] =concentração da substância em mol / L; k = constante da velocidade específica para cada temperatura. . Pressão a proximidade das moléculas número de colisões velocidade da reação SARDELLA, Antônio. QUÍMICA. Série Novo Ensino Médio. Edição compacta. Volume único. Ática. São Paulo – SP, 2003. Cinéticaquímica.http://www.slideshare.net/Aikhaa/ cintica-qumica. Acessado em 29-10-2009 Cinéticaquímica<http://images.google.com.br/img res?> Acessado em 29-10-2009
Download















![V = k . [reagente]coeficiente](http://s1.livrozilla.com/store/data/000708237_1-04b0a24e45ff78b3cc4dbb36f01b4d4c-260x520.png)


