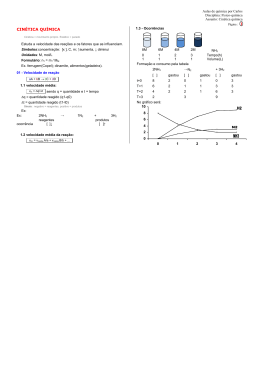
Os átomos das moléculas dos reagentes estão sempre em movimento gerando muitas colisões (choques). Quanto mais choques com energia e geometria adequada houver, maior a velocidade da reação. Nem toda colisão é efetiva. Para que uma colisão resulte em uma reação química, ela precisa ter orientação e energia adequadas. O aumento da concentração provoca o aumento da velocidade de reação por provocar uma maior área de contato entre os reagentes. Portanto quanto maior a concentração dos reagentes, maior a velocidade de reação. Concentração Velocidade de Reação O aumento da temperatura gera uma maior agitação nas moléculas de reagentes, possibilitando um maior número de colisões. Temperatura Velocidade de Reação Um exemplo disso em nosso dia-a-dia é a conservação de alimentos na geladeira ou freezer. No verão o bolor no pão cresce mais rápido. Quanto mais íntimo for o contato entre os reagentes maior a probabilidade de haver uma colisão efetiva entre os reagentes. É por isso que a reação entre gases é mais veloz que a reação entre líquidos, que por sua vez é mais rápida que a reação entre sólidos A queima de fogos de artifício é uma reação entre substâncias sólidas, pulverizadas para aumentar a área de contato. Portando, quanto maior a área de contato entre os reagentes, maior a velocidade de reação. Área de contato Velocidade de Reação Um catalisador é uma substância que afeta a velocidade de uma reação, mas emerge do processo inalterada. Um catalisador normalmente muda a velocidade de reação, promovendo um caminho molecular diferente (mecanismo) para a reação. Exemplo: A decomposição da água oxigenada é normalmente muito lenta. Porém na presença de dióxido de manganês essa reação acontece com uma velocidade muito maior. O catalisador diminui a energia de ativação de uma reação e, portanto, aumenta a velocidade de reação. 1)(Fuvest - SP) Na reação representada por A + B → C + D, uma elevação de temperatura produz um aumento de velocidade da reação porque aumenta: a) a pressão do sistema em reação. b) o volume do sistema em reação. c) a concentração dos reagentes. d) a energia de ativação dos reagentes e) a frequência de colisões efetivas dos reagentes 2) (UFMG) Três experimentos foram realizados para investigar a velocidade de reação entre HCl aquoso diluído e ferro metálico. Para isso foram contadas, durante 30 segundos, as bolhas de gás formadas imediatamente após os reagentes serem misturados. Em cada experimento, usou-se o mesmo volume de uma mesma solução de HCl e a mesma massa de ferro, variando-se a forma de apresentação da amostra de ferro e a temperatura. Experimento Ferro (2 g) Temperatura I Prego 40 °C II Prego 20 °C III Palha de Aço 40 °C Determine em ordem crescente os experimentos que apresentaram mais bolhas. 3)(UFPE) Explique as seguintes observações experimentais: a) H2O2 puro no estado no estado líquido pode ser estocado sem que ocorra decomposição visível. A adição de pequena quantidade de MnO2 sólido ao H2O2 provoca decomposição rápida em H2O e O2 . b) Magnésio em pó reage com oxigênio do ar muito mais rapidamente que o magnésio na forma de lâmina.
Download