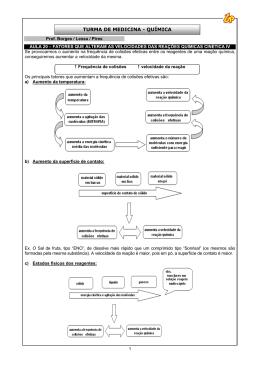
A VELOCIDADE DAS REAÇÕES Cinética química é a parte da química que estuda a velocidade das reações químicas e os fatores que influenciam esta velocidade. O conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso diaa-dia. Por exemplo, quando guardamos alimentos na geladeira para retardar sua decomposição ou usamos panela de pressão para aumentar a velocidade de cozimento dos alimentos. As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas. Velocidade de reação A velocidade de uma reação é medida pela quantidade de reagente que é consumindo ou pela quantidade de produto que é formado em função do tempo. Vm = ∆Q ∆t Considerando a reação : N2(g) + 3H2(g) → 2 NH3(g) VReação Global = ∆[N2] 1 = ∆[H2] = ∆[NH3] 3 Vconsumo N2 = ∆[N2] ∆t Vconsumo H2 = ∆[H2] ∆t Vformação NH3 = ∆[NH3] ∆t 2 29 Condições para ocorrência de uma reação • Natureza dos reagentes: quando uma reação ocorre é porque temos uma “afinidade” entre os reagentes. • Contato entre reagentes: esta é uma condição fundamental para que se possa haver reação, sem contato não teremos, a princípio uma reação ocorrendo. • Choques ou colisões: acreditamos que os choques eficientes entre os reagentes levam a quebra de ligações ocasionando a reação. Teoria da Colisão Pela teoria da colisão, para haver reação é necessário que: • • • as moléculas dos reagentes colidam entre si ; a colisão ocorra com geometria favorável à quebra das ligações; a energia das moléculas que colidem entre si seja suficiente para quebrar as ligações. Teoria da Colisão Colisão efetiva ou eficaz é aquela que resulta em reação, isto é, que está de acordo com as duas últimas condições da teoria da colisão. O número de colisões efetivas ou eficazes é muito pequeno comparado ao número total de colisões que ocorrem entre as moléculas dos reagentes. Complexo Ativado Complexo ativado é uma estrutura intermediária de grande energia entre os reagentes e os produtos, com ligações intermediárias entre as dos reagentes e as dos produtos. 30 → Reagentes → complexo ativado produtos Energia de Ativação Energia de ativação é a energia mínima necessária para a formação do complexo ativado. • Quanto menor for a energia de ativação de uma reação, maior será sua velocidade. H H Complexo Ativado Complexo Ativado Produto Energia de Ativação Reagente Reagente Energia de Ativação Produto Caminho do Processo Caminho do Processo Reação Endotérmica Reação Exotérmica Fatores que influenciam a velocidade da reação Estado físico dos reagentes Geralmente os gases reagem mais facilmente e mais rapidamente que os líquidos, e estes mais rapidamente que os sólidos. Nos gases, as moléculas reagentes se deslocam com muita liberdade e rapidez. Os choques entre elas são muito frequentes e, consequentemente, a reação é em geral mais rápida. Quando dois líquidos miscíveis são misturados, para que eles reajam, o contato entre suas moléculas ainda é mais fácil. Mais difícil se torna a reação entre dois líquidos imiscíveis. 31 Temperatura Calor Frio Uma elevação da temperatura aumenta a velocidade de uma reação porque aumenta o número de colisões entre as moléculas e o número de moléculas dos reagentes com energia superior à de ativação. Regra de van't Hoff “ Uma elevação de 10°C na temperatura duplica a velocidade de uma reação.” • Esta é uma regra aproximada e muito limitada Superfície de Contato Jacobus H. Van 't Hoff Quando fragmentamos os reagentes, aumentamos a superfície de contato entre eles. Assim,o número de colisões aumenta e a velocidade da reação será maior. Aumento da superfície de contato 32 No nosso dia-a-dia observamos que : • • • 1kg de carne moída cozinha mais rapidamente do que 1 kg de carne em pedaços. 1 m3 de lenha fina queima mais rapidamente do que 1 m3 de lenha grossa. 1 comprimido efervescente triturado reage mais rapidamente com a água do que o comprimido inteiro. Nos três exemplos acima observamos a influência da superfície de contato. A reação será mais rápida com o zinco em pó devido a maior superfície de contato. Concentração O aumento da concentração dos reagentes aumenta o número de moléculas por volume. Assim,o número de colisões será maior e a velocidade da reação aumenta. Lei da ação das massas “ A velocidade de uma reação será diretamente proporcional ao produto das molaridades dos seus reagentes elevados a expoentes determinados experimentalmente.” aA + bB + ... → produtos • • • • • v = k [A]p [B]q p e q são experimentalmente determinados k = constante de velocidade de reação(aumenta com a temperatura ) p = ordem da reação em relação a A q = ordem da reação em relação a B p + q + ... = ordem da reação Reagente gasoso - A pressão de um gás é diretamente proporcional à sua concentração em mol/L. Por isso, no caso de reagente(s) gasoso(s), a lei de velocidade pode ser expressa em termos de pressão. 33 Para : aA(g) + bB(g) + ... → produtos temos: v = k·ppA·pqB O aumento da pressão aumenta a velocidade da reação. Quando não há reagente gasoso, a pressão não influi na velocidade da reação. Reação elementar é aquela que ocorre numa única etapa. Neste caso, para aA + bB + ... → produtos, temos: v = k [A]a [B]b Mecanismo de reação é o conjunto das etapas em que ocorre a reação. A etapa lenta é a que determina a velocidade da reação. O mecanismo de uma reação é proposto com base no estudo de sua velocidade. Catálise e catalisador Catálise é uma reação na qual toma parte um catalisador. Catalisador é uma substância que aumenta a velocidade de uma reação, permanecendo inalterado qualitativa e quantitativamente no final da reação. A ação do catalisador é abaixar a energia de ativação. O abaixamento da energia de ativação é que determina o aumento da velocidade da reação. • Catálise homogênea - Catalisador e reagentes constituem uma só fase. Reação não catalisada (uma etapa ) : A2(g) + B2 (g) → 2 AB(g) Reação catalisada ( Duas etapas ) : A2(g) + B2(g) + C(g) ) → A2(g) + B2C(g) A2(g) + B2C(g) → 2 AB(g) + C(g) 34 Existem catalisadores especiais, utilizados no escapamento dos automóveis, que conseguem transformar alguns dos gases venenosos emitidos (dentre eles CO, NO e NO2) em gases não venenosos, como CO2 e N2. Entre as muitas reações que ocorrem nesse processo, podemos citar: 2CO + 2NO catalisador Venenosos 2CO + O2 não-venenosos catalisador Venenoso 2NO2 + O2 2CO2 + 3N2 2CO2 não-venenoso catalisador Venenoso 2CO2 não-venenoso 35 Os conversores catalíticos são bastante efetivos. Os gases produzidos pelo motor ficam em contato com o catalisador por apenas 100 a 400 milissegundos, tempo suficiente para que 96% do CO seja convertido em CO2 e a emissão de óxidos de nitrogênio seja reduzida em 76%. • Catálise heterogênea - Catalisador e reagentes constituem duas ou mais fases (sistema polifásico ou mistura heterogênea). Enzima é uma proteína que atua como catalisador em reações biológicas. Caracteriza-se pela sua ação específica e pela sua grande atividade catalítica. Apresenta uma temperatura ótima, geralmente ao redor de 36,5°C, na qual tem o máximo de atividade catalítica. Promotor de reação ou ativador de catalisador é uma substância que ativa o catalisador, mais isoladamente não tem ação catalítica na reação. A reação : N2 + 3 H2 → 2 NH3 36 é catalisado por ferro; se adicionarmos pequenas quantidades de K2O ou Aℓ2O3, a ação catalítica do ferro ficará muito mais acentuada. Dizemos, então, que o K2O ou Aℓ2O3 agem como promotores ou ativadores do ferro. Inibidor é uma substância que diminui a velocidade de uma reação agindo de forma contrária ao catalisador,porém o inibidor é consumido na reação. Na reação : 400°C CH4 + Cℓ2 CH3Cℓ + HCℓ A adição de pequenas quantidades de oxigênio retarda a reação; tão logo, porém, o oxigênio seja consumido, a reação retoma sua velocidade primitiva. Atualmente, os inibidores são muito usados na conservação de alimentos, bebidas e outros perecíveis. Veneno (ou Anticatalisador) é a substância que diminui ou mesmo anula o efeito de um catalisador. No exemplo anterior: N2 + 3H2 Fe 2NH3 a presença de pequenas quantidades de arsênio ou compostos do arsênio diminui ou anula o efeito do ferro como catalisador. Autocatálise : Quando um dos produtos da reação atua como catalisador. No início, a reação é lenta e, à medida que o catalisador (produto) vai se formando, sua velocidade vai aumentando. CH2COOC2H5 + H2O → CH3COOH + C2H5OH éster água ácido álcool Essa reação é extremamente lenta. No entanto, logo que se formam as primeiras porções do ácido, esse passa a agir como catalisador da reação, acelerando o processo. 37
Download