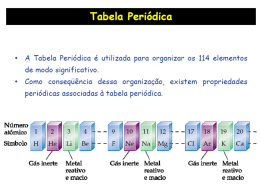
Geometria Molecular • As estruturas de Lewis nos mostram o número e os tipos de ligações entre os átomos. • A forma espacial de uma molécula é determinada por seus ângulos de ligação. • Ex. CCl4: ângulos de ligação Cl-C-Cl são de 109,5°. • Conseqüentemente, a molécula não pode ser plana. • Todos os átomos de Cl estão localizados nos vértices de um tetraedro com o C no seu centro. REPULSÃO DOS PARES ELETRÔNICOS O MÉTODO VSEPR VSEPR: Valence-Shell Electron-Pair Repulsion • O arranjo geométrico mais estável é aquele em que as repulsões entre os pares eletrônicos é mínima. A molécula assume uma geometria 3D que minimize essa repulsão. • Repulsão entre os pares eletrônicos: pl-pl < pnl-pl < pnl-pnl VSEPR • Encontrar a estrutura de Lewis • Determinar o número estérico = número de átomos ligados + número de pares livres. > Ângulo < Forças Repulsivas EXEMPLOS • BeH2 Be: 1s2 2s2 H: 1s1 Linear NE = 2 • BF3 B: 1s2 2s2 2p1 F: 1s2 2s2 2p5 Trigonal Plana NE = 3 • CH4: Td (ângulo ~109º) ou QP (ângulo 90º) ? C: 1s2 2s2 2p2 H: 1s1 H H C H NE = 4 Tetraédrica (Td) H • PCl5 P: 1s2 2s2 2p6 3s2 3p3 Cl: 1s2 2s2 2p6 3s2 3p5 NE = 5 Bipirâmide Trigonal • SF6 S: 1s2 2s2 2p6 3s2 3p4 F: 1s2 2s2 2p5 NE = 6 Octaédrica Octaedro Geometria molecular quando estão presentes pares de elétrons livres. • NO2N: 1s2 2s2 2p3 O: 1s2 2s2 2p4 ..N O O Angular NE = 3 NE = 4 • NH3 N: 1s2 2s2 2p3 H: 1s1 Tetraédrica (Td) .. N H H H Pirâmide Trigonal NE = 4 • H2O O: 1s2 2s2 2p4 H: 1s1 ..O.. H NE = 4 H Angular Ângulos de Ligação: • Como os elétrons em uma ligação são atraídos por dois núcleos, eles não se repelem tanto quanto os pares solitários. • Os ângulos de ligação diminuem quando o número de pares de elétrons não-ligantes aumenta. H H C H H 109.5O H N H H 107O O H H 104.5O NE = 5 • Bipirâmide Trigonal: posições axial (a) e equatorial (e) • Regra de Bent: Os átomos mais eletronegativos tendem a ocupar posição axial. • Par solitário: posição equatorial. NE = 5 • SF4 S: 1s2 2s2 2p6 3s2 3p4 F: 1s2 2s2 2p5 Gangorra NE = 5 • ClF3 Cl: 1s2 2s2 2p6 3s2 3p5 F: 1s2 2s2 2p5 Forma de “T” • XeCl2 Xe: ... 5s2 5p6 Cl: 1s2 2s2 2p6 3s2 3p5 NE = 5 NE = 5 Linear NE = 6 • BrF5 Br: ... 4s2 4p5 F: 1s2 2s2 2p5 NE = 6 Pirâmide Tetragonal • XeF4 Xe: ... 5s2 5p6 F: 1s2 2s2 2p5 NE = 6 Quadrado Planar VSEPR - Moléculas com mais de um átomo central Acetileno HC CH C: 1s2 2s2 2p2 H: 1s1 Linear • Etileno H2C C2H H H C H C H Trigonal Plana NE Pares Livres Geometria 2 0 Linear 3 0 Trigonal Plana 3 1 Angular NE Pares Livres Geometria 4 0 Tetraédrica 4 1 Pirâmide Trigonal 4 2 Angular NE Pares Livres Geometria 5 0 5 1 5 2 “T” 5 3 Linear Bipirâmide Trigonal Gangorra NE Pares Livres Geometria 6 0 6 1 Pirâmide Tetragonal 6 2 Quadrado Planar Octaédrica Para determinar a estrutura real: • Desenhe a estrutura de Lewis, • Calcule o NE • Ordene os átomos ligados e os pares de elétrons em uma das geometrias acima para minimizar a repulsão e--e-. POLARIDADE DAS MOLÉCULAS • Depende da polaridade da ligação e da geometria molecular. • MOLÉCULA APOLAR: O centro de cargas positivas coincide com o centro de cargas negativas. • MOLÉCULA POLAR: Há separação de cargas (dipolos). Medida da Polaridade • A polaridade das moléculas pode ser medida observando-se seu comportamento frente a um campo elétrico. • As moléculas polares tendem a se alinhar com o campo elétrico. • Obtém-se o momento dipolar (µ) expresso em Debyes (D) • Exemplo: H2 µ = 0 D HCl µ = 1,08 D POLARIDADE DE MOLÉCULAS DIATÔMICAS • Polaridade da molécula depende apenas da polaridade da ligação. • Exemplos: H2 ligação apolar, molécula apolar HCl ligação polar, molécula polar POLARIDADE DE MOLÉCULAS TRIATÔMICAS • Polaridade da molécula depende da polaridade da ligação e da geometria molecular. • Cada ligação química “torna-se” um vetor que terá sentido para o átomo mais eletronegativo. • Efetuar a soma vetorial. Ligações Polares Geometria Linear Resultante = 0 Molécula Apolar Ligações Polares Geometria Angular Resultante ≠ 0 Molécula Polar OUTRAS MOLÉCULAS H .. F N B H H Ligações Polares Geometria: Pirâmide Trigonal Resultante ≠ 0 Molécula Polar F F Ligações Polares Geometria: Trigonal Plana Resultante = 0 Molécula Apolar A polaridade de uma molécula depende de sua geometria molecular.
Download