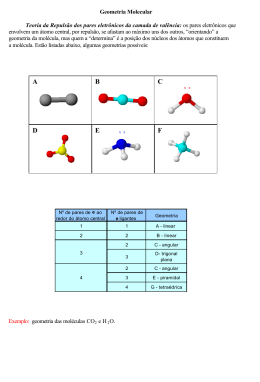
Geometria e Polaridade Molecular Geometria Molecular É o estudo de como os átomos estão distribuídos espacialmente em uma molécula. As principais classificações são: linear, angular, trigonal plana, piramidal e tetraédrica. Para se determinar a geometria de uma molécula, é preciso conhecer a teoria da repulsão dos pares eletrônicos da camada de valência. VSEPR (repulsão dos pares de elétrons da camada de valência) Baseia-se na idéia de que pares eletrônicos da camada de valência de um átomo central, estejam fazendo Ligação química ou não, se comportam como nuvens eletrônicas que se repelem, ficando com a maior distância angular possível uns dos outros. Uma nuvem eletrônica pode ser representada por uma ligação simples, dupla, tripla ou mesmo por um par de elétrons que não estão a fazer ligação química. Geometria Molecular No quadro a seguir, podemos observar a relação da geometria das moléculas com número de nuvens eletrônicas localizadas ao redor do átomo central. Linear HCl l80º HBr Linear CO2 180º Angular H2O 104,5º Trigonal Plana BF3 120º Pirâmide Trigonal NH3 107,3º Tetraédrica CH4 109,28º Polaridade Molecular A polaridade de uma molécula é verificada pelo valor do momento de dipolo →µ A polaridade de moléculas com mais de dois átomos é expressa por: →µR (momento dipolo resultante). H2 H─H HF H ─F CO2 O═C ═ O HCN H ─ C≡N geometria linear →µ = zero geometria linear →µ ≠ 0 geometria linear →µ = 0 geometria linear →µ ≠ 0 Apolar Polar Apolar Polar Para determinar o momento dipolar devem-se considerar dois fatores: a) A escala de eletronegatividade, que nos permite determinar a orientação dos vetores de cada ligação: b) A geometria da molécula, que nos permite determinar a disposição espacial desses vetores. EXEMPLOS H2O Polar Amônia(NH3) Polar HCCl3 Polar CH4 Apolar
Download