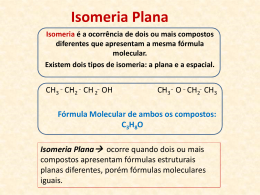
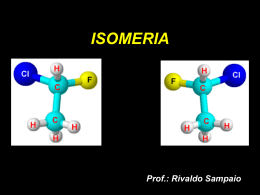
Química ISOMERIA Prof. Dra. Andréa Junqueira Isomeria Química É o fenômeno pelo qual substâncias que apresentam mesma fórmula molecular apresentam fórmulas estruturais diferentes. iso = igual meros = parte Classificação Química Plana Isomeria 1. Cadeia 2. Posição 3. Função 4. Metameria 5. Tautomeria 1. Geométrica Espacial 2. Ótica Química Isomeria plana Ocorre quando a diferença entre os isômeros pode ser explicada observando-se apenas as fórmulas estruturais planas. Química 1. Isomeria de cadeia É o fenômeno onde compostos de mesma fórmula molecular, pertencentes a mesma função e que diferem no tipo de cadeia carbônica. CH3- CH = CH2 C3H6 Propeno CH2 Ciclopropano CH2- CH2 Química 1. Isomeria de cadeia CH3 CH3- CH - CH3 C4H10 Metil - propano CH3- CH2- CH2 - CH3 Butano Química 2. Isomeria de posição É o fenômeno onde dois ou mais compostos de mesma fórmula molecular, pertencentes à mesma função e que diferem na posição de radicais ou da insaturação (ligações duplas ou triplas). 1 2 3 4 CH2=CH-CH2-CH3 Buteno-1 C4H8 1 2 3 4 CH3-CH=CH-CH3 Buteno-2 2. Isomeria de posição Química 3 2 1 CH3- CH2- CH2- OH Propanol-1 C3H8O 1 2 3 CH3- CH- CH3 OH Propanol-2 Química 3. Isomeria de Função É o fenômeno onde dois ou mais compostos de mesma fórmula molecular que pertencem a funções diferentes. Os casos mais comuns de isomeria plana de função ocorrem entre: • Álcoois e Éteres; • Aldeídos e Cetonas; • Ácido Carboxílicos e Ésteres. Química 3. Isomeria de Função Álcoois e Éteres; CH3- CH2 – OH Etanol C2H6O CH3- O - CH3 Metóxi-metano Química 3. Isomeria de Função Aldeídos e Cetonas; CH3- CH2 - CHO C3H6O Propanal CH3 - CO - CH3 Propanona Química 3. Isomeria de Função Ác.Carboxílicos e Ésteres; CH3- CH2 -COOH C3H6O2 Ác. Propanóico CH3 -COO- CH3 Etanoato de metila Química 4. Metameria (compensação) Isomeria de compensação ocorre quando os isômeros diferem pela posição de um heteroátomo na cadeia carbônica. CH3- CH2 -O- CH2 - CH3 C4H10O Etóxi-etano CH3 -O- CH2 - CH2 - CH3 Metóxi-propano 5. Tautomeria Química É o caso particular de isomeria funcional onde os dois isômeros ficam em equilíbrio dinâmico. Enol CH2 H C OH Aldeído H CH3 - C Tautomeria aldo-enólica O 5. Tautomeria Química O OH CH2 C Enol CH3 CH3 C Cetona Tautomeria Ceto-enólica CH3 Química Exercício: 01) Construa a fórmula estrutural e verifique o tipo de isomeria que ocorre entre os compostos abaixo: a) 2- buteno e ciclobutano b) 2-metil-pentano e 3-metil-pentano c) Butanal e butanona 16 Química Isomeria Espacial É aquela que pode ser explicada por meio de estruturas (fórmulas) espaciais. É também chamada ESTERIOISOMERIA. Química 1. Isomeria Geométrica Também chamada de isomeria CIS-TRANS. Os compostos têm a mesma fórmula estrutural plana, mas há que se considerar átomos ligantes espacialmente. Veja exemplos que seguem. 1. Isomeria Geométrica Química Modelos para o composto ClCH=CHCl TRANS CIS Carbono Hidrogênio Cloro Química 1. Isomeria Geométrica Condições para ocorrência: 1- Compostos com ligação dupla e cada carbono com dupla deve possuir os dois radicais diferentes. 2- Compostos cíclicos que possuam dois carbonos com dois radicais diferentas em cada um. 3- Compostos alênicos (derivados do propadieno). Compostos com dupla ligação Química O composto 1,2-Dicloro-Eteno pode ser representado de duas maneiras: Estruturas diferentes = Características diferentes. CIS TRANS Como diferenciar as duas estruturas? Química Compostos com dupla ligação Cis – Quando os radicais mais simples estiverem do mesmo lado. Trans – Quando os radicais mais simples estiverem em lados opostos. Química Compostos com dupla ligação Escreva o nome e diferencie os isômeros geométricos abaixo: Química Compostos cíclicos Possuem isomeria geométrica sem a necessidade de uma ligação dupla. A regra: traçar uma linha imaginária entre os carbonos onde há isomeria geométrica e observar, pelas prioridades, quem é cis e trans. Química Compostos cíclicos Escreva o nome e diferencie os isômeros geométricos abaixo: Química 2. Isomeria Óptico Todos os isômeros - propriedades físicas diferentes (Pf, Pe e d), Isômeros ópticos não possuem esta diferença. Então o que faz eles serem diferentes? É possível diferenciá-los? Sim, é possível diferenciá-los, mas apenas quando eles estão frente à luz polarizada. Os isômeros ópticos - desviar a luz polarizada. Química 2. Isomeria Óptico Enantiômero Dextrógiro (D, +) - provoca o giro da luz polarizada para a direita. Enantiômero Levógiro (L, -) - provoca o giro da luz polarizada para a esquerda. Mistura Racêmica - ópticamente inativa (mistura de 50% de dextrógiro com 50% de levógiro. Química Condição para atividade óptica: • Carbono assimétrico ou quiral ou estereocentro. O carbono quiral é marcado com um asterísco (*), este carbono possui todos os ligantes diferentes. * Nos compostos enantioméricos, um é a imagem especular do outro, ou seja, um é a imagem refletida do outro. No entanto, eles não são superponíveis. Química 2. Isomeria Óptico Determinação do nºde isômeros ópticos (lei de van't Hoff) : Compostos com 1C* - Um dextrógiro, um levógiro e um racêmico (equimolares do dextrógiro e levógiro). Compostos com 2C* diferentes – Dois dextrógiros, dois levógiros, formando dois pares de antípodas ópticos e dois racêmicos. Compostos com 2C* iguais – Um levógiro, um dextrógiro, um racêmico e um meso (inativo por compensação interna). Compostos com nC* diferentes - 2n isômeros opticamente ativos, sendo 2n-1 dextrógiros, 2n-1 levógiros e 2n-1 racêmicos. 2. Isomeria Óptico Química Sobre a molécula do 3-metil-2-pentanol, responda: 2 estereocentros a) Quantos enantiomorfos possui a molécula? IOA = 2n = 22 = 4, 4 isômeros ópticos ativos b) Quantos enantiomorfos levógiros possui a molécula? IOA(-) = 2n-1 = 22-1 = 2, 2 isômeros levógiros
Download