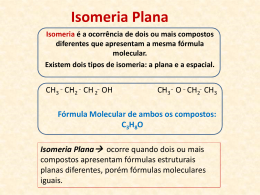
Química Orgânica: Isomeria Profº Benevides Almeida ISOMERIA Conceito É o fenômeno através do qual dois ou mais compostos apresentam mesma fórmula molecular e propriedades diferentes em virtude da disposição diferente dos átomos na molécula. Conceito Com a fórmula C2H6O temos duas substâncias: H3C – CH2 – OH Função álcool, líquido incolor, P.E.= 78,5°C, apresenta moderada reatividade química. H3C – O – CH3 Função éter, gás incolor, liquefaz a -23°C, apresenta baixa reatividade química. Tipos de Isomeria Isomeria Plana – Os isômeros podem ser diferenciados pela fórmula estrutural plana. Isomeria Espacial ou Estereoisomeria – Os isômeros são diferenciados pelas suas estruturas espaciais. • • Isomeria Geométrica Isomeria Óptica Isomeria Plana A isomeria plana é dividida em 5 partes: isomeria de função, de cadeia, de posição, metameria e tautomeria. Isomeria de Função ou Funcional Na isomeria de função os compostos possuem diferenças apenas entre a função química. Veja alguns exemplos: Aldeído Cetona Ácido Carboxílico C3H 6O Propanal Éster C4H8O2 Propanona Ácido Butanóico Etanoato de Etila Outros exemplos comuns são isomeria funcional entre álcool e éter, álcool aromático e fenol. Isomeria Plana Isomeria de Cadeia ou Núcleo Os compostos possuem a mesma função, mas possuem diferenças entre as suas cadeias. Hidrocarboneto Hidrocarboneto C4H10 C3 H 6 Butano Metilpropano Propeno Ciclopropano Cadeia aberta, normal, saturada e homogênea cadeia aberta, ramificada, saturada e homogênea cadeia aberta, normal, insaturada e homogênea cadeia fechada, normal, saturada e homogênea Isomeria Plana Isomeria de Posição Os isômeros de posição possuem cadeias iguais e possuem a mesma função, mas possuem diferenças na posição do grupo funcional, ramificação ou insaturação. 2-Propanol Álcool Alcino C3H7OH C4 H 6 1-Propanol 1-Butino 2-Butino Isomeria Plana Metameria ou Isomeria de Compensação A metameria é um caso particular da isomeria de posição. Nela, os metâmeros pertencem à mesma função, possuem cadeias iguais e a única diferença é a posição de um heteroátomo. Etóxi Etano Éter Éster C4H10O C3H6O2 Metóxi Propano Metanoato de Etila Etanoato de Metila Outros exemplos de metameria são entre as aminas ou entre as amidas comuns e substituídas. Isomeria Plana Tautomeria ou Isomeria Dinâmica Este é um caso especial da isomeria de função, onde os isômeros coexistem em um equilíbrio químico. Os tautômeros mais comuns são os enóis e as cetonas ou os enóis e os aldeídos. A diferença é a posição da hidroxila insaturada: em um carbono 1 ela gera um aldeído e em um carbono localizado no meio de uma cadeia ela gera uma cetona. Exemplos: Aldeído Enol Cetona C2H 4O Etanal Enol C3H 6O Etenol Propanona Propen-2-ol Isomeria Plana Tautomeria ou Isomeria Dinâmica A explicação pode ser dada através de conceitos simples como densidade eletrônica e carga parcial, como na animação abaixo. O exemplo utilizado será de um aldeído, mas também é possível explicar a tautomeria ceto-enólica. Isomeria Geométrica A isomeria geométrica ou Cis – Trans trata de casos onde há diferenças apenas na posição de alguns átomos em uma estrutura tridimensional. Condições para ocorrência: 1- Compostos com ligação dupla e cada carbono do laço duplo deve possuir os dois radicais diferentes. 2- Compostos cíclicos que possuam dois carbonos com dois radicais diferentas em cada um. 3- Compostos alênicos (derivados do propadieno). Isomeria Geométrica Compostos com ligações duplas. O composto 1,2-Dicloro-Eteno pode ser representado de duas maneiras: R 1 ≠ R2 e R 3 ≠ R4 Estruturas diferentes = Características diferentes. Como diferenciar as duas estruturas? Isomeria Geométrica Compostos com ligações duplas. Antes de seus nomes utilizam-se prefixos para indicar a posição de seus átomos ou radicais. Cis – Quando os radicais mais simples estiverem do mesmo lado. Trans – Quando os radicais mais simples estiverem em lados opostos. A orientação é sempre dada a partir do maior número atômico para átomos diferentes e de tamanho, quando os números atômicos forem iguais, para radicais. O prefixo cis- indica que as partes de maior prioridade estão em uma mesma parte de um plano imaginário que corta a molécula. O prefixo trans- indica que as partes de maior prioridade estão em lados opostos da molécula. Isomeria Geométrica Compostos com ligações duplas. Escreva o nome e diferencie os isômeros geométricos abaixo: Isomeria Geométrica Compostos Cíclicos Possuem isomeria geométrica sem a necessidade de uma ligação dupla. A regra para determinar quem é cis e quem é trans é a mesma dos compostos acíclicos: traçar uma linha imaginária entre os carbonos onde há isomeria geométrica e observar, pelas prioridades, quem é cis e trans. Isomeria Geométrica Compostos Cíclicos Escreva o nome e diferencie os isômeros geométricos abaixo: Isomeria Óptica Todos os isômeros possuem propriedades físicas diferentes, tais como PF, PE e densidade, mas os isômeros ópticos não possuem esta diferença, ou seja, as propriedades físicas dos isômeros ópticos são as mesmas. Então o que faz eles serem diferentes? É possível diferenciá-los? Sim, é possível diferenciá-los, mas apenas quando eles estão frente à luz polarizada. Os isômeros ópticos são compostos capazes de desviar a luz polarizada. Isomeria Óptica Enantiômero Dextrógiro (D, +) - provoca o giro da luz polarizada para a direita. Enantiômero Levógiro (L, -) - provoca o giro da luz polarizada para a esquerda. Mistura Racêmica - ópticamente inativa (mistura de 50% de dextrógiro com 50% de levógiro. Isomeria Óptica Condição para que um composto tenha atividade óptica: • Carbono assimétrico ou quiral ou estereocentro. * O carbono quiral é marcado com um asterísco (*),este carbono possui todos os ligantes diferentes. Nos compostos enantioméricos, um é a imagem especular do outro, ou seja, um é a imagem refletida do outro. No entanto, eles não são superponíveis. Isomeria Óptica Determinação do número de isômeros ópticos (lei de van't Hoff) : Compostos com 1C* - Um isômero dextrógiro, um levógiro e um racêmico (formado por quantidades equimolares do dextrógiro e levógiro). Compostos com 2C* diferentes - Dois isômeros dextrógiros, dois isômeros levógiros, formando dois pares de antípodas ópticos e dois racêmicos. Compostos com 2C* iguais - Um isômero levógiro, um dextrógiro, um racêmico e um meso ou mesógiro (inativo por compensação interna). Compostos com nC* diferentes - 2n isômeros opticamente ativos, sendo 2n-1 dextrógiros, 2n-1 levógiros e 2n-1 racêmicos. Isomeria Óptica Sobre a molécula do 3-metil-2-pentanol, responda: 2 estereocentros a) Quantos enantiomorfos possui a molécula? IOA = 2n = 22 = 4, 4 isômeros ópticos ativos b) Quantos enantiomorfos levógiros possui a molécula? IOA(-) = 2n-1 = 22-1 = 2, 2 isômeros levógiros
Download