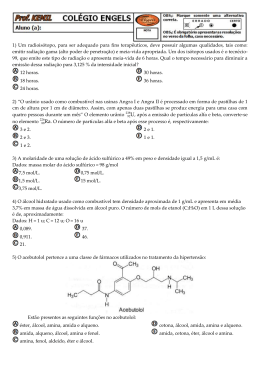
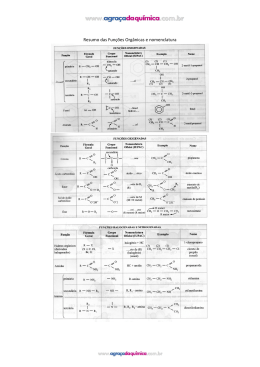
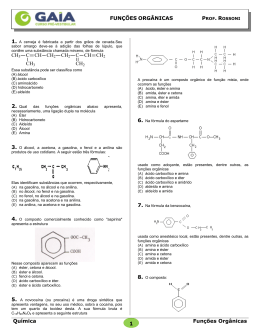
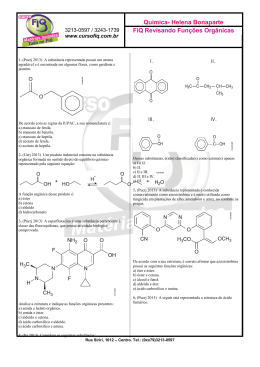
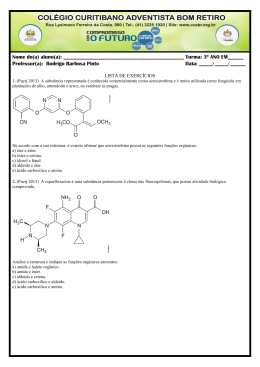
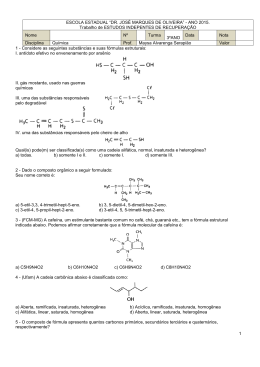
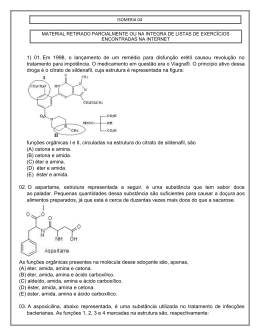
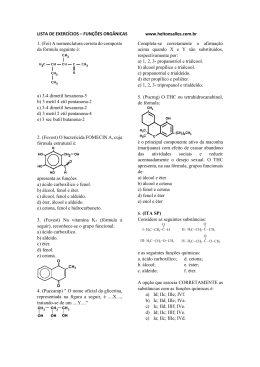
ALUNO(a): _______________________________________________ Nº: ____ SÉRIE: 2ª UNIDADE: VV Valor: TURMA:_____ JC JP PC 5,0 DATA: ___/___/2015 Obs.: Esta lista deve ser entregue apenas ao professor no dia da aula de Recuperação 1. (PUC-MG) O princípio ativo dos analgésicos comercializados com nomes de Tylenol, Cibalena, Resprin é o paracetamol, cuja fórmula está representada a seguir. Os grupos funcionais presentes no paracetamol são a) fenol, cetona e amina. b) álcool, cetona e amina. c) álcool e amida. d) fenol e amida. e) amina e amida. 2. (UFPI-PI) O composto antibacteriano ácido oxalínico é representado pela fórmula estrutural: e apresenta as seguintes funções: a) éster, cetona, amina e éter. b) éter, cetona, amina e ácido carboxílico. c) éster, amida, amina e ácido carboxílico. d) éster, amina, fenol e cetona. e) éter, amida, éster e amina. 3. a) b) c) d) e) 4. (UFPI-PI) Amburosídeo B (Phytochemistry 50, 71-74, 2000), cuja estrutura é dada a seguir, foi isolada de 'Amburana cearensís' (imburana-de-cheiro ou cumaru) na busca pelo principio ativo responsável pela atividade antimalárica da mesma. Escolha a alternativa que apresenta quatro funções orgânicas presentes no Amburosídeo B. Fenol; Cetona; Ácido carboxílico; Álcool Cetona; Éter; Éster; Álcool Cetona; Éter; Ácido carboxílico; Álcool Fenol; Éter; Éster; Álcool Fenol; Cetona, Éter; Álcool Utilizando os espaços designados na figura, identifique a função química que representa cada um dos grupos funcionais. 1 2015 - LISTA DE RECUPERAÇÃO - QUÍMICA - ARTHUR - 2º ANO - 2º TRI 5. a) b) c) d) e) 6. (PUC-PR) Marque a alternativa que contém as palavras que completem corretamente a seguinte frase: "Quando o grupo hidroxila estiver ligado diretamente a um carbono saturado, teremos um_____________ e quando estiver ligado diretamente a um carbono insaturado do anel benzênico, teremos um _________". Álcool e Enol Fenol e Álcool Álcool e Fenol Álcool e Ácido carboxílico Ácido carboxílico e Álcool (UEL-PR) Você já sentiu o ardido de pimenta na boca? Pois bem, a substância responsável pela sensação picante na língua é a capsaicina, substância ativa das pimentas. Sua fórmula estrutural está representada a seguir. Os grupos funcionais característicos na capsaicina são a) Cetona, álcool e amina. b) Ácido carboxílico, amina e cetona. c) Amida, éter e fenol. d) Cetona, amida, éster e fenol. e) Cetona, amina, éter e fenol. 7. (UFSCAR-SP) Estudos pré-clínicos têm demonstrado que uma droga conhecida por aprepitante apresenta ação inibitória dos vômitos induzidos por agentes quimioterápicos citotóxicos, tais como a cisplatina. Essa droga apresenta a seguinte fórmula estrutural: Duas das funções orgânicas encontradas na estrutura dessa droga são a) cetona e amina. c) amina e éter. b) cetona e éter. d) amina e éster. 8. (FGV-SP) A figura representa a fórmula estrutural da substância éster benzílico do quinuclidinol, conhecida como BZ, utilizada como arma química. Essa substância é um sólido que pode ser disperso na forma de um aerossol, produzindo alucinações, vertigem, perda de orientação e amnésia. Duas das funções orgânicas existentes na estrutura dessa substância são a) éter e amida. c) fenol e éter. b) álcool e amina. d) fenol e amida. 9. e) amida e éster. e) cetona e amina. (UFV-MG) O composto denominado Carolignana A, cuja fórmula está representada adiante, foi isolado no Departamento de Química da UFV a partir da planta 'Ochroma lagopus', popularmente conhecida como balsa devido à baixa densidade de sua madeira, que é utilizada para o fabrico de caixões e jangadas. 2 Os grupos funcionais presentes na estrutura da Carolignana A, a partir da fórmula representada, são a) fenol, éter, éster, alqueno, anidrido. d) fenol, aldeído, éster, éter, alqueno. b) alqueno, fenol, anidrido, éster, cetona. e) amina, éter, éster, alqueno, álcool. c) fenol, éter, éster, alqueno, álcool. 10. (UFSM-RS) As moléculas a seguir são o malation e o ácido 2,4 D, dois pesticidas usados na agricultura. Esses contaminantes polares são muito solúveis em água, sendo arrastados para os rios pelas chuvas. Sobre o malation e o ácido 2,4 D, pode-se afirmar que a) possuem carbonilas. c) possuem ciclos aromáticos. b) são éteres. d) são ésteres. e) possuem átomos halogênios. 11. Com base nas reações de combustão (não balanceadas) dos combustíveis listados abaixo, assinale o que for correto. Dados: H = 1 g/mol, C = 12 g/mol, O = 16 g/mol 01. 02. 04. 08. O gás hidrogênio (H2) é o combustível relacionado que libera mais energia por grama. A reação que consome mais gás oxigênio (O2) é a combustão do etanol (C2H5OH). As reações de combustão apresentadas são reações endotérmicas. O metano (CH4) libera mais energia por grama que o metanol (CH3OH). 12. A indústria siderúrgica utiliza-se da redução de minério de ferro para obter o ferro fundido, que é empregado na obtenção de aço. A reação de obtenção do ferro fundido é representada pela reação: Fe2O3 + 3CO Dados: Entalpia de formação ( o H f) 2 Fe + 3CO2 a 25ºC, kJ/mol. o A entalpia de reação (ΔH r) a 25°C é a) 24,8 kJ/mol b) –24,8 kJ/mol c) d) 541,2 kJ/mol –541,2 kJ/mol e) 1328,2 kJ/mol 13. O bicarbonato pode ser utilizado para apagar pequenos incêndios, em função da liberação de gás carbônico, conforme a equação: 2NaHCO3 (s) Na2CO3(s) + H2O(l) + CO2 (g). Utilizando os dados de entalpia padrão de formação dessas substâncias, Substâncias ΔHº (kJ mol NaHCO3 (s) 947,0 Na2CO3 (s) 1130,0 H2O(l) 286,0 CO2 (g) 394,0 3 1 ) pode-se afirmar que a reação é o a) exotérmica e apresenta valor de H = – 84 kJ. o b) endotérmica e apresenta valor de H = 84 kJ. o c) endotérmica e apresenta valor de H = 680 kJ. o d) exotérmica e apresenta valor de H = – 680 kJ. 14. O acetileno, conhecido pela nomenclatura IUPAC por etino, apresenta uma queima extremamente exotérmica, o qual é bastante utilizado em processos de soldagem, corte de metais por maçarico e em diversos processos que requeiram alta temperatura. Sua reação de decomposição pode ser representada pela seguinte equação balanceada: C2H2(g) 2C(s) + H2(g) –1 H = –226 kJ.mol Em relação a essa equação, é correto afirmar: a) Há uma liberação de calor, constituindo-se uma reação endotérmica. –1 b) 2 mols de acetileno produzem 226 kJ.mol de calor. c) A entalpia dos produtos é igual à dos reagentes. d) Ocorre a liberação de calor, constituindo-se uma reação exotérmica. e) Invertendo-se a equação, a quantidade de calor envolvida na reação e o sinal da entalpia não se alteram. 15. Assinale a(s) alternativa(s) correta(s). ( ) Quando um processo endotérmico ocorre em um sistema à pressão constante, esse sistema absorve calor do ambiente e sua entalpia aumenta. ( ) O H de uma reação depende do estado físico dos reagentes e dos produtos. ( ) O H de uma reação depende da quantidade de reagentes e de produtos. ( ) A queima de 1 mol de carbono grafite libera a mesma quantidade de energia liberada na queima de 1 mol de carbono diamante. ( ) Se a energia da ligação C–C é 348 kJ/mol, pode-se concluir que a energia da ligação C C é 1.044 kJ/mol. 16. Dadas as seguintes equações: A. 2CO(g) + O2(g) 2CO2(g) B. 2CH4O(g) + 3O2(g) C. 3O2(g) D. Fe2O3(g) + 3C(s) 2CO2(g) + 4H2O(l) 2O3(g) H = – 65,6 kJ H = – 1452,6 kJ H = + 426,9 kJ 2Fe(s) + 3CO(g) H = + 490,8 kJ Considere as seguintes proposições em relação às equações: I. As reações (A) e (B) são endotérmicas. II. As reações (A) e (B) são exotérmicas. III. As reações (C) e (D) são exotérmicas. IV. As reações (C) e (D) são endotérmicas. V. A reação com maior liberação de energia é a (B). VI. A reação com maior liberação de energia é a (D). Assinale a alternativa correta. a) Somente as afirmativas II, III e V são verdadeiras. b) Somente as afirmativas I, III e VI são verdadeiras. c) Somente as afirmativas I, IV e VI são verdadeiras. d) Somente as afirmativas II, V e VI são verdadeiras. e) Somente as afirmativas II, IV e V são verdadeiras. 17. Diariamente, podemos observar que reações químicas e fenômenos físicos implicam em variações de energia. Analise cada um dos seguintes processos, sob pressão atmosférica. I. A combustão completa do metano (CH4) produzindo CO2 e H2O. II. O derretimento de um iceberg. III. O impacto de um tijolo no solo ao cair de uma altura h. Em relação aos processos analisados, pode-se afirmar que a) I é exotérmico, II e III são endotérmicos. b) I e III são exotérmicos e II é endotérmico. c) I e II são exotérmicos e III é endotérmico. d) I, II e III são exotérmicos. e) I, II e III são endotérmicos. 4 18. Um dos maiores problemas do homem, desde os tempos pré-históricos, é encontrar uma maneira de obter energia para aquecê-lo nos rigores do inverno, acionar e desenvolver seus artefatos, transportá-lo de um canto a outro e para a manutenção de sua vida e lazer. A reação de combustão é uma maneira simples de se obter energia na forma de calor. Sobre a obtenção de calor, considere as equações a seguir. C(grafite) + O2(g) CO2(g) H = –94,1 kcal H2O(l) 1 O2(g) 2 H = +68,3 kcal CH4(g) H = –17,9 kcal H2(g) + C(grafite) + 2H2(g) Assinale a alternativa que apresenta, corretamente, o valor do calor de combustão ( H) do metano (CH4) na equação a seguir. CH4(g)+ 2O2(g) CO2(g)+ 2H2O(l) a) b) c) d) e) –212,8 kcal –144,5 kcal –43,7 kcal +144,5 kcal +212,8 kcal 19. A reação de redução óxido de cobre II (CuO(s)) pelo grafite (C(s)) pode ser representada pela equação (1): (1) 2 CuO(s) + C(s) 2Cu(s) + CO2 (g) H= ? Dados: A equação (2) e (3) mostram os H de outras reações: (2) Cu(s) + 1/2O2(g) CuO(s) H = –39 kcal (3) C(s) + O2(g) CO2 (g) H = –93 kcal Com base nesses dados, pode-se afirmar que a reação (1) tem H (em kcal) igual a a) +171 (reação endotérmica) b) –15 (reação exotérmica) c) +132 (reação endotérmica) d) –54 (reação exotérmica) e) +15 (reação endotérmica) 20. Dadas as equações termoquímicas: 2 H2 (g) + O2 (g) N2O5 (g) + H2O (l) H = –571,5 kJ 2H2O (l) H = –76,6 kJ 2 HNO3 (l) ½ N2(g) + 3/2 O2 (g) + ½ H2 (g) HNO3 (l) H = –174 kJ Assinale a alternativa com o valor da variação de entalpia, H, para a reação: 2 N2 (g) + 5 O2 (g) a) – 36,7 kJ b) – 28,7 kJ c) + 36,7 kJ d) + 28,7 kJ e) + 38,3 kJ 5 2 N2O5 (g)
Download