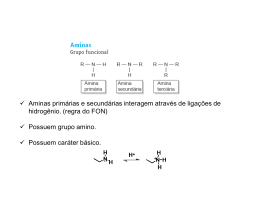
Aminas Introdução à Química Orgânica As aminas • Nomenclatura • • • • • Metilamina ou metanamina (1ª) Etilmetilamina ou N-metiletanamina (2ª) Dietilamina ou N-etiletanamina (2ª) Trietilamina ou N,N-dietiletanamina Arilaminas: • Anilina ou benzenamina, N-metilanilina ou N-metilbenzenamina, p-toluidina ou 4-metilbenzenamina. As aminas • Propriedades físicas • Moderadamente polar • Ligações de H (primárias, secundárias e terciárias) • Estrutura • • • • Um par de elétrons não compartilhado na última camada N sp3 Tetraédricas, considerando o par de elétrons Quiralidade Propriedades físicas das aminas Basicidade • Bases fracas (mais forte que a água, mais fraca que o hidróxido e os alcóxidos, por exemplo) • Comparação da basicidade: pKa do íon amínio (significado) • Aminas comuns, alifáticas: pKa entre 9 e 11 • Basicidade das arilaminas • Comparação com amidas (muito pouco básicas) • Sais de amônio • Solubilidade das aminas em meio aquoso ácido Basicidade amina x amida Aminas heterocíclicas Síntese de aminas • Substituição nucleofílica, alquilação da amônia (alquilações múltiplas!) • Alquilação do íon azida • Síntese de Gabriel: ftalimida de potássio • Redução de nitrocompostos (aminas aromáticas) • Aminação redutora de aldeídos e cetonas • Redução de nitrilas, oximas e amidas • Degradação de Hofmann: • R-CO-NH2 + Br2 + 4NaOH → R-NH2 + 2 NaBr + Na2CO3 + 2H2O Síntese de Gabriel Reações das aminas com ácido nitroso • Aminas primárias • Alifáticas: sal de diazônio instável, forma carbocátion altamente reativo • Aromáticas: sal de diazônio estável abaixo de 5oC (arenodiazônio) • A partir desse sal, diversos compostos aromáticos podem ser produzidos • Aminas secundárias • Formação de N-nitrosaminas • Aminas terciárias • Pouco importante Compostos aromáticos a partir de sais de arenodiazônio Outras reações de aminas • Acoplamento de sais de diazônio: azocompostos • Eliminação de Hofmann: formação do alceno menos substituído a partir de hidróxido de amônio quaternário
Download