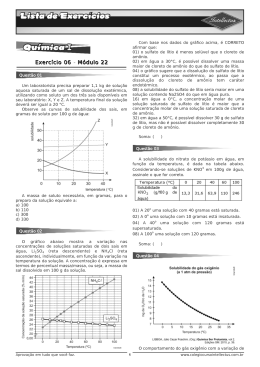
QUÍMICA – 2ª SÉRIE EM TAREFA DA SEMANA DE 23 DE JUNHO A 27 DE JUNHO – 12ª SEMANA 1. (Mackenzie) Dissolveu-se 0,08g de hidróxido de sódio em água suficiente para preparar 2 litros de solução. O pH da solução resultante é igual a: Dados: massa molar (g/mol): Na = 23; O = 16; H = 1 Número atômico: Na = 11; O = 8; H = 1 a) 3 b) 4 c) 8 d) 10 e) 11 2. (Ufrrj) Em um potenciômetro, se faz a leitura de uma solução 0,001M de hidróxido de sódio (utilizado na neutralização do ácido lático). Sabendo-se que o grau de dissociação é total, o valor do pH encontrado corresponde a a) 2,7. b) 5,4. c) 12,0. d) 11,0. e) 9,6. 3. (Ufsm) Para sobreviverem, os animais aquáticos apresentam limites de resistência em relação ao pH das águas em que habitam. Por exemplo, o pH de sobrevivência das conchas é 5,5, dos camarões é 5,8, dos caramujos é 7,0 e dos paramécios é 9,0. A seguir, analise e complete a tabela para as soluções. De acordo com a informação e com os dados obtidos na tabela, pode-se dizer que sobreviverão, nas soluções B e C, respectivamente, a) camarões e paramécios. b) caramujos e camarões. c) conchas e paramécios. d) paramécios e caramujos. e) paramécios e conchas. 4. (Ufpe) A solubilidade da sacarose (C12H22O11) em água aumenta com a temperatura, enquanto a do sulfato de lítio (Li2SO4) diminui com o aumento da temperatura. Isto ocorre porque: a) a sacarose é um composto covalente e o sulfato de lítio é um composto iônico. b) a dissolução da sacarose é endotérmica e a do sulfato de lítio é exotérmica. c) a água funciona como ácido de Bronsted e reage exotérmicamente com o sulfato de lítio. d) a sacarose não dissolve facilmente em água por ser um composto covalente e o sulfato de lítio dissolve facilmente em água por ser um composto iônico. e) a dissolução do sulfato de lítio aumenta a entropia. 5. (Fatec) As solubilidades em água, a 20 °C, de algumas substâncias e suas respectivas massas molares, são apresentadas na tabela a seguir: Considerando-se - volumes iguais de soluções saturadas a 20 °C dessas substâncias e - os sais totalmente dissociados. A substância que apresentará maior número de partículas em solução é a de a) NaNO3 b) NaBr c) NaI d) C12H22O11 e) (NH4)2SO4 6. (Unimontes) Em um laboratório, o seguinte procedimento foi realizado, conforme mostrado no esquema a seguir: 20 mL de ácido clorídrico a 36,5 % de massa por volume, presentes em uma proveta, foram adicionados em um balão volumétrico de 1 litro e completou-se o volume com água. Em relação a esse procedimento, é CORRETO afirmar que a) a condutividade elétrica é menor na solução do balão volumétrico. b) a concentração molar do ácido clorídrico no balão é 0,1 mol/L. c) o número de mols de íons cloreto é maior na solução da proveta. d) as concentrações das soluções da proveta e do balão são iguais. 7. (Ufscar) Sal de cozinha (cloreto de sódio) e açúcar (sacarose) são sólidos brancos solúveis em água. Suas soluções aquosas apresentam comportamentos completamente diferentes quanto à condução de corrente elétrica. É correto afirmar que: a) o cloreto de sódio é um composto iônico e sua solução aquosa conduz corrente elétrica, devido à presença de moléculas de NaCℓ. A sacarose é um composto covalente e sua solução aquosa tem viscosidade muito alta, diminuindo a condutividade da água. b) uma substância como o cloreto de sódio, que em solução aquosa forma íons, é chamada de eletrólito. A solução de sacarose conduz corrente elétrica, devido à formação de ligações de hidrogênio entre as moléculas de sacarose e água. c) o cloreto de sódio é um composto iônico e suas soluções aquosas conduzem corrente elétrica, devido à presença de íons livres. A sacarose é um composto constituído de moléculas e suas soluções aquosas não conduzem corrente elétrica, pois as moléculas neutras de sacarose não contribuem para o transporte de cargas. d) a dissolução de sacarose em água leva à quebra das moléculas de sacarose em glicose e frutose e estas moléculas conduzem corrente elétrica. A solução de sal, por sua vez, apresenta condutividade menor que a da água destilada. e) soluções aquosas de sacarose ou de cloreto de sódio apresentam condutividade elétrica maior do que aquela apresentada pela água pura, pois há formação de soluções eletrolíticas. Os íons formados são os responsáveis pelo transporte de cargas em ambos os casos. 8. (Pucsp) Dado: coloração do indicador azul de bromotimol pH < 6 solução amarela 6 < pH < 8 solução verde pH > 8 solução azul Em um béquer foram colocados 20,0 mL de solução aquosa de hidróxido de sódio (NaOH) de concentração 0,10 mol/L e algumas gotas do indicador azul de bromotimol. Com auxílio de uma bureta foram adicionados 20,0 mL de uma solução aquosa de ácido sulfúrico (H2SO4) de concentração 0,10 mol/L. A cada alíquota de 1,0 mL adicionada, a mistura resultante era homogeneizada e a condutibilidade da solução era verificada através de um sistema bastante simples e comum em laboratórios de ensino médio. Uma lâmpada presente no sistema acende quando em contato com um material condutor, como água do mar ou metais, e não acende em contato com materiais isolantes, como água destilada, madeira ou vidro. A respeito do experimento é correto afirmar que a) após a adição de 10,0 mL da solução de H2SO4, a solução apresenta coloração azul e a lâmpada acende. b) após a adição de 10,0 mL da solução de H2SO4, a solução apresenta coloração verde e a lâmpada não acende. c) após a adição de 12,0 mL da solução de H2SO4, a solução apresenta coloração azul e a lâmpada acende. d) após a adição de 12,0 mL da solução de H2SO4, a solução apresenta coloração amarela e a lâmpada acende. e) após a adição de 20,0 mL da solução de H2SO4, a solução apresenta coloração verde e a lâmpada não acende.
Download