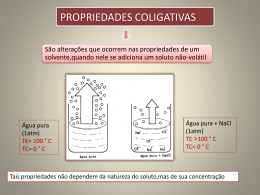
Propriedades Coligativas Propriedades coligativas São propriedades que surgem pela presença de um soluto e dependem única e exclusivamente do número de partículas que estão dispersas na solução, não dependendo da natureza do soluto. Isso significa dizer que a quantidade, e não a qualidade (e.g. tamanho, estrutura molecular ou massa), das partículas que estão dispersas na solução é que irá influenciar na intensidade das propriedades (ou efeitos) coligativa. Tonoscopia: diminuição da pressão máxima de vapor. Ebulioscopia: elevação da temperatura de ebulição. Crioscopia: diminuição da temperatura de fusão. Osmoscopia: pressão osmótica. A TONOSCOPIA A tonoscopia é uma propriedade coligativa que ocasiona o abaixamento da pressão de vapor de um líquido, quando a ele se adiciona um soluto não-volátil. Se adicionarmos um soluto não-volátil em solvente, ocorre a diminuição da pressão de vapor e consequentemente, demora mais tempo para evaporar. A pressão de vapor de um solvente puro sempre será maior do que a pressão de vapor de uma solução. Com a adição das partículas do soluto intensificam-se as forças atrativas moleculares e diminui a pressão de vapor do solvente. Veja um exemplo de pressão de vapor da água pura e em solução: Água pura (25°C) = Pv=23,76mmHg Solução 1mol/L de glicose (25°C) = Pv=23,34mmHg Solução 1mol/L de sacarose (25°C) = Pv=23,34mmHg Quanto maior a quantidade de partículas em uma solução, menor será a sua pressão de vapor. A EBULIOSCOPIA • EBULIOSCOPIA é a propriedade coligativa correspondente ao aumento do ponto de ebulição de um líquido quando acrescenta-se a ele um soluto não-volátil (que não evapora). É como se as partículas do soluto "segurassem" as partículas do solvente, dificultando sua passagem ao estado gasoso. O aumento (variação) da temperatura de ebulição pode ser justificado pela diminuição da pressão máxima de vapor, que se deve à presença das partículas do soluto. Para que ocorra a ebulição da solução, é necessário que ela seja aquecida até que sua pressão de vapor se iguale à pressão atmosférica. A Crioscopia •A Crioscopia é o estudo da diminuição do ponto de congelamento de um líquido causado pelo soluto não-volátil. A fórmula abaixo permite calcular a Crioscopia: Δtc = Tc2 - Tc, onde: Tc = temperatura de congelamento da solução Tc2 = temperatura de congelamento do solvente O fenômeno da Crioscopia ocorre quando se adiciona um soluto não-volátil a um solvente, as partículas deste soluto dificultam a cristalização do solvente dando origem à propriedade descrita. Exemplo prático: Por que quando colocamos água pura e suco de frutas para congelar, o suco congela depois? Em razão das propriedades crioscópicas presentes.
Download