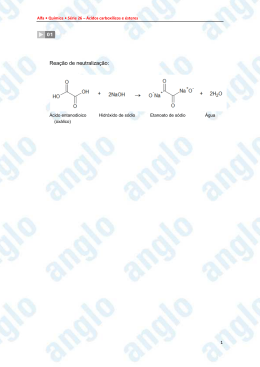
Ácidos Carboxílicos Na química orgânica, ácidos carboxílicos são ácidos orgânicos caracterizados pela presença do grupo carboxila. Em fórmulas químicas, esses grupos são tipicamente representados como COOH. Moléculas que possuem tal grupo funcional também são chamadas ácidos carboxílicos ou ácidos orgânicos. Fórmula geral: R é um radical orgânico alquila, alquenila, arila ou hidrogênio. - COOH é o grupo funcional carboxila. R - CO- é um radical orgânico acila. Estrutura molecular Os dois átomos eletronegativos de oxigênio tendem a afastar o elétron do hidrogênio do grupo hidroxila, e o próton restante pode permitir mais facilmente. A carga negativa restante é então distribuída igualmente entre os dois átomos de oxigênio, e as duas ligações carbono-oxigênio adquirem características de dupla ligação parcial (i.e., elas são deslocalizadas). Esse é um resultado da estrutura ressonante criada pelo componente carboxila do ácido carboxílico, sem o qual o grupo OH não pode perder tão facilmente seus H+ (veja álcool). Ao grupo COO- denomina-se-lhe carboxilato. O íon resultante é tipicamente nomeado com o sufixo "ato", como ácido acético, por exemplo, tornando-se íon acetato. Nomenclatura Oficial O sufixo da função Ácido Carboxílico é -ÓICO e o nome deve ser acompanhado da palavra Ácido. Esta nomenclatura é igual, em regras, à dos Aldeídos. Veja: O Carbono 1 será sempre o Carbono da Carboxila. Em caso de duas, o Carbono 1 será a que der os menores números para as ramificações e depois para as instaurações. Em caso de duas Carboxilas, usa-se o prefixo DIÓICO, sem necessidade de informar posição, pois as mesmas sempre se encontram na extremidade das cadeias. Caso o Ácido seja ramificado, pode-se indicar as posições 2, 3 e 4 com as letras gregas a,b e g, respectivamente. Geralmente esta numeração é utilizada em Ácidos com apenas uma ramificação e não é muito usada atualmente, não podendo ser usada para indicar posição de instaurações. Nomenclatura usual Alguns Ácidos Carboxílicos possuem nomenclatura usual, que geralmente está associada a sua fonte natural. Derivados do Ácidos Carboxílicos • Sais Orgânicos • Ésteres • Anidridos Orgânicos • Cloreto dos Ácidos Carboxílicos Sais Orgânicos Existem duas acepções para o termo sal orgânico: Em química , São compostos originários da reação de uma base inorgânica com um acido carboxílico. Na alimentação, "sal orgânico", também chamado sal marinho, é a designação vulgar do cloreto de sódio, o sal de cozinha não refinado não tratado com suplementos alimentares tais como os iodetos, principalmente iodeto de sódio (NaI), que é necessário ao funcionamento da tiróide, ou com aditivos anti-aglomerantes. Tecnicamente, "sal orgânico" é um oximoro: o cloreto de sódio é sempre inorgânico, já que não contêm carbono e hidrogênio na sua estrutura . Exemplo: Esta reação resulta em um sal orgânico e água, como o exemplo genérico abaixo: Onde R é um radical orgânico ou Hidrogênio e Me é um metal ou NH4+ (Amônio). O radical destacado em azul chama-se Acilato. Os sais possuem nomenclatura oficial e usual. Nomenclatura Oficial - Sais Orgânicos A nomenclatura oficial dos sais utiliza o prefixo -ATO e é muito parecida com a dos Ésteres. Veja as regras de nomenclatura: Identificar o número de carbonos preso ao Acilato, dando nomenclatura de Hidrocarboneto seguido do prefixo -ATO. Se for necessário numerar, o Carbono 1 será o Carbono do Acilato. Identificar o metal ou NH4+, colocando antes de seu nome o nome da parte do Acilato e a preposição DE. Se o ânion do Acilato for bivalente e dois cátions diferentes estiverem ligados a ele, antes da preposição DE utiliza-se a palavra DUPLO e entre o nome dos cátions coloca-se a conjunção E. Se o ânion do Acilato for bivalente e apenas um cátion estiver ligado a ele, antes da preposição DE coloca-se a palavra ÁCIDO. Nomenclatura Usual-Sais Orgânicos A nomenclatura usual dos sais é diferente da oficial apenas na parte do Acilato. Assim como nos Ésteres, o Acilato recebe o nome usual do seu ácido de origem. Portanto, utilizando um dos exemplos anteriores, temos: Ésteres Na química orgânica e bioquímica, os ésteres constituem o grupo funcional (R´-COOR"), que consiste em um radical orgânico unido ao resíduo de qualquer ácido oxigenado, orgânico ou inorgânico. Um éster é o produto da reação de um ácido (geralmente orgânico) com um álcool (o hidrogênio do ácido R-COOH é substituído por um grupo alquilo R"). Os ésteres mais comuns que se encontram na natureza são as gorduras e os óleos vegetais, os quais são ésteres de glicerol e de ácidos graxos. Os ésteres resultam freqüentemente da condensação (uma reação que produz água) de um ácido carboxílico e de um álcool. Ao processo dáse o nome de esterificação. Ésteres de ácidos orgânicos Os ésteres são derivados de ácidos pela substituição do hidrogênio do ácido por um radical orgânico. São possíveis ésteres sulfurados (exemplo: acetil-CoA), ésteres de fosfato (ex: ATP), porém os mais importantes são os ésteres de ácidos carboxílicos. Alguns deles estão representados abaixo: Fórmula geral: onde R e R1 são radicais orgânicos Exemplos: Nomenclatura (Nome do ânion derivado do ácido substituindo o sufixo ICO por ATO) de (Nome do radical) CH3COO - CH3 → Acetato de metila ou etanoato de metila CH3 - CH2 - COO - CH2 - CH3 → propanoato de etila CH3 - COO - CH2 - CH2 - CH2 - CH3 → Etanoato de butila CH2 = C (CH3) - COO - CH3 → metil propenoato de metila, o monômero do acrílico (plástico) Anidridos Orgânicos Os Anidridos são originários da desidratação de duas moléculas de Ácidos Carboxílicos. O nome da função ANIDRIDO (AN = sem, IDRO = água) já evidencia a desidratação. Em uma reação genérica, temos: Onde R1 e R2 são dois radicais orgânicos (iguais ou não). O Ácido Metanóico ao sofrer desidratação libera CO e H2O, sendo assim o único a não formar Anidrido. Os Anidridos possuem nomenclatura oficial e usual, de acordo com os ácidos que o originaram. A nomenclatura oficial - Anidridos A nomenclatura oficial dos Anidridos tem origem na dos Ácidos que o formaram. Veja as regras: Antes do nome do Anidrido, colocar a palavra ANIDRIDO, para designar a função. Dar o nome da menor parte do Anidrido do mesmo jeito que se daria a um Ácido, apenas retirando a palavra ÁCIDO do nome e depois da maior parte. Em Anidridos cujas partes são iguais, não é necessário repetir o nome. Em casos que seja necessário numerar, o Carbono 1 é sempre o Carbono do Acilato. A nomenclatura usual dos Anidridos A nomenclatura usual dos Anidridos é feita a partir da nomenclatura usual dos Ácidos que os originaram. Cloretos dos Ácidos Carboxílicos Cloretos de ácido Os cloretos de ácido são todos os compostos orgânicos que derivam dos ácidos carboxílicos pela substituição do – OH pelo cloro. Nomenclatura dos cloretos de ácido A nomenclatura dos cloretos de ácido também possui regras básicas. Após empregar a palavra cloreto, deve-se em seguida usar a preposição de, depois o nome do ácido deve ter terminação ila Trabalho de Química Nome: Vanessa Anainara Nome: Ingrid Gouveia Nome: Eder Ferraz Nome: Fabrício Nome: Marcio Nome: Vitor Cesar Nome: Wanderlley
Download