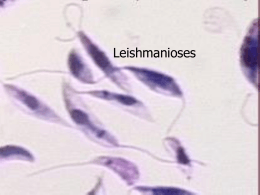
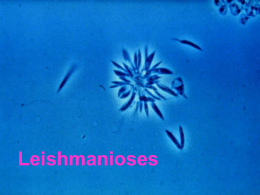
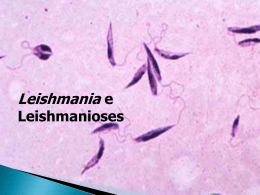
Leishmania sp e Leishmaniose Reino Protista Sub-reino Protozoa Filo Sarcomastigophora Subfilo Mastigophora Ordem Kinetoplastida GêneroLeishmania (Ross, 1903) Amastigota Promastigota Formas evolutivas da Leishmania spp. Estimativa da incidência de Leishmanioses na população mundial WHO, 1990 WHO, 1991 • 12 milhões de pessoas infectadas em todo o mundo • 350 milhões em risco de contaminação • número 3 a 5 vezes maior que o relatado (ocorrência da doença em áreas remotas, convivência com foco zoonótico) Vetor - Flebotomíneos Hospedeiros 1 Distribuição geográfica Manifestações Clínicas As Leishmanioses tem ampla distribuição geográfica no LEISHMANIOSES Brasil, sendo encontrada em praticamente todo território Nacional. Visceral Tegumentar Magé Leishmaniose Tegumentar Histórico Mesquita Realengo C. Grande, Bangu Jacarepa guá Século XVI 1535 - Fernando de Olviedo 1571 - Pedro Pizarro Doença com destruição das cavidades nasais - Índios nos vales da encosta da Cordilheira dos Andes Em algumas áreas do estado do Rio de Janeiro as leishmanioses Século XVIII - 1756 - Alexander Russel Paciente Turco Botão d’Alep são endêmicas. Século XIX 1884/ 1885 – Cerqueira - Botão de Briska (Argélia-África) 1885 – Cunninghan- 1a observação do parasita em MØ Século XX 1903 – Ross-define o Gênero Leishmania - Wright-parasita do Botão do Oriente L. Tropica 1a década – identificação na América Latina Úlcera de Baurú ou do Noroeste Século XX •1908 – Tamoyo-peça de cerâmica peruana – UTA - LMC •1908 - Lindenberg, Carini e Paranhos lesões em pacientes no Brasil e América Central •1911 - Gaspar Vianna-L. braziliensis •1912 - Gaspar Vianna-ação curativa do Tártaro Emético •Década de 20-papel dos flebótomos na transmissão •1926 – Montenegro-intradermo reação •1953 – Biagi-Úlcera dos Chicleros (Iucatã – México) L. tropica guyanensis (Pian Bois) •1972 – Lainson e Shaw-Difuso Cutânea Amazonense (L. mexicana amazonensis e L. braziliensis panamensis) •1773 – Lainson e cols-Indígenas do Amazonas •1996 – Coimbra e cols-Amazônia Brasileira – LTA até o momento nas populações indígenas Espécies dermotrópicas do Novo Mundo Subgênero Leishmania complexo L. mexicana L. amazonensis L. mexicana Subgênero Viannia complexo L. braziliensis L. braziliensis L. peruviana complexo L. guyanensis L. guyanensis L. panamensis L. lainsoni L. naiffi 2 LESÃO CUTÂNEA Leishmaniose Tegumentar Americana FORMA MUCOSA RECIDIVA CUTÂNEA: lesão única, lesões múltiplas ou lesões de recidiva MUCO CUTÂNEA: lesões mucosas e presença concomitante de lesões cutâneas em atividade MUCOSA: lesões mucosas sem a presença de lesões cutâneas ativas HISTÓRICO DA LEISHMANIOSE VISCERAL •1835– Hidra (Grécia) esplenomegalia em crianças •1885 – Cunningham-agente da doença – Calazar na Índia •1890-1900 – Assam (Índia)-vilas inteiras despovoadas •1903– Leishman e Donovan- agente do Calazar Indiano – Ross- posição sistemática – Gênero Leishmania e L. donovani (Calazar) •1904 – casos na China e Tunísia •1911 e 1912 – Carlos Chagas-Vale do Rio Amazonas, suspeita de Calazar •1912 a 1914 – áreas endêmicas na Itália Meridional, Grécia, Espanha e Portugal •1913 – Migone- 1o caso reportado na América do Sul (Paraguai) - Casos na Síria, Irã, Turquestão, Cáucaso, Austrália e França •1977 – surto epidêmico em Bihar (Índia) •1926 •1934 •1935 •1953 – – – e 70.000casos/7% de óbitos 2 casos na Argentina 41 casos no Brasil (viscerotomia hepática “pós-mortem”) início de surto epidêmico no Brasil Ceará (800 casos) 1954 – Epidemia no Quênia (África) 3.000 casos Brasil - Final dos anos 60 Extensa campanha profilática •1967 – Mayrink - “Somente assim evitar-se-á a reprodução, no futuro, de casos como o que presenciamos na cidade de Itanhomi, onde de uma família de 8 pessoas, 6 membros tiveram suas vidas ceifadas pelo Calazar” 3 •1980 a 1983 - 5.000 casos por ano •1987 a 1988 - 26.000 novos casos notificados por ano (Norte e Nordeste) Espécies viscerotrópicas do Novo Mundo Subgênero Leishmania complexo L. donovani L. chagasi Leishmaniose Visceral esplenomegalia hepatomegalia hiperplasia e hipertrofia das células do SFM hiperplasia das células do SFM e dilatação dos sinusóides renais cutâneas alterações 2arias pulmonares Não tratados 90% de mortalidade nos linfonodos no tubo digestivo no tecido hemocitopoiético Profilaxia DIAGNÓSTICO O diagnóstico se divide em três categorias principais: Diagnóstico parasitológico Diagnóstico imunológico 4 Métodos moleculares Tratamento problemática desvantagens soluções FÁRMACOS CONSIDERAÇÕES Pentostam Antimoniais Pentavalentes - Introduzidos desde a década de 40 Ativo na maioria dos casos - Mecanismo de ação (limitado) OMS - 20mg/Kg/dia -20 dias no mínimo Extremamente tóxicos - Complicações renais e cardíacas Pacientes imunossuprimidos se mostram resistentes (Estibogliconato de Sódio) Glucantime (Antimoniato de Meglumina) Pentamidina (Diamidina Aromática) Anfotericina B (Antibiótico Poliênico) Droga de 2a escolha - LV resistente ao tratamento convencional LDC e LMC causadas por L. aethiopica OMS - intramuscular - 3 a 4mg/Kg/3x por semana - 5 a 25 semanas Tóxica - grandes quantidades nos rins e fígado meses pós tratamento Amplo espectro contra organismos com ergosterol na membrana LMC na América do Sul / LV resistentes a Glucantime e Pentamidina OMS - intravenosa 10mg/Kg dias alternados Agente mais promissor para LV e casos resistentes a Pentamidina FÁRMACOS Abelcelt - AmB ATIVIDADE Índia - 3mg/Kg/dia - 5 dias - 100% de cura (complexado à um lipídeo) (Berman, 1998) Amphotec - AmB Brasil - 2mg/Kg/dia - 7 dias - 100% de cura (forma liposomal) (Berman, 1998) Ambisoma-AmB (com dispersão em colesterol) Paramomicina (Aminosidina) Cetoconazol WR6026 (8-aminoquinolina) Sendo testado em pacientes imunossuprimidos (Berman, 1998) Quênia - 14 a 16mg/Kg/dia - 19 dias - 79% de cura (Berman, 1998) + L. mexicana - L. braziliensis (Croft e cols, 1997) Quênia - 10 anos - baixas doses via oral (promissora) (Chance, 1995; Croft e cols, 1997) - interferon Efetivo em LV e LC (não conclusivo) (+/- antimoniais pentavalentes) (Berman, 1998) 5
Download