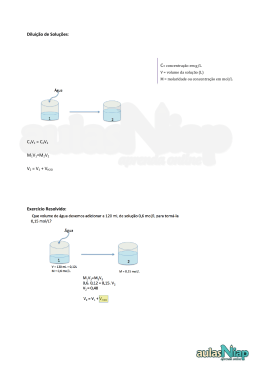
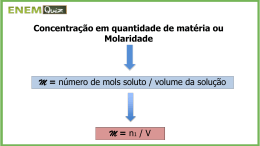
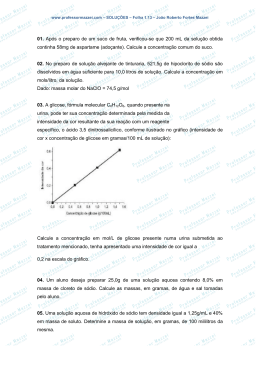
QFL – 2142 Fundamentos de Química: Transformações Cálculos envolvendo Soluções e Cálculo Estequiométrico Elementar 1) Pessoas cuja análise de sangue mostra uma concentração de etanol no sangue de 3,0 mg L-1 geralmente apresentam sinais óbvias de intoxicação. Estima-se que a concentração fatal seja 7,0 mg L-1.. Determine o volume de um “scotch whisky 80 proof” (40 % em volume de etanol) correspondente à diferença entre uma dose fatal e uma dose intoxicante para uma pessoa que tem 7,0 L de sangue. Dado: densidade do etanol = 0,80 g mL-1. 2) Um método de descascar batatas comercialmente é imergi-las numa solução de NaOH 10 a 20 % em massa numa temperatura entre 60 e 88 oC por um tempo entre 1 e 5 minutos, retirálas e descascá-las através de um jateamento de água. Para determinar se a solução de NaOH ainda está nos padrões para uso após um dia de operação, um técnico observou que uma amostra de 10,0 mL requereu 64,0 mL de uma solução de H2SO4 0,200 mol L-1 para a sua neutralização. O técnico determinou que a densidade da solução de NaOH era igual a 1,10 g cm-3. Determine se a solução ainda está dentro das especificações calculando a porcentagem em massa de NaOH na solução. Massas molares: NaOH = 40 g/mol e H2SO4 = 98 g/mol. 3) Calcule a porcentagem em massa do soluto num ácido clorídrico sabendo que, ao reagir uma amostra de determinada massa com uma solução aquosa de nitrato de prata (em excesso), obtém se um precipitado de cloreto de prata cuja massa, depois de lavado e seco, é igual à massa da amostra de ácido. Calcule também o volume da quantidade dessa solução que contem dissolvido 1,00 mol de soluto sabendo que sua densidade é igual a 1,126 g mL-1. 4) Deseja-se reagir 10,00 g de uma amostra de Fe com HCl segundo a reação Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g) empregando uma solução de ácido clorídrico 6,020mol/kg , cuja densidade corresponde a 1,0878 g /mL. (a) Converta a unidade de concentração para (i) porcentagem em massa e (ii) concentração (molar). (b) Calcule o erro que você comete quando despreza a massa do soluto no cálculo da molaridade. Discuta. (c) Determine, empregando dados tabelados (veja página seguinte), a condição na qual molaridade = molalidade para o HCl(aq) e analise. (d) Calcule o menor volume do ácido necessário para reagir com a amostra de Fe. (e) Calcule o erro que você comete quando cozinha de forma errada. Discuta. INFORMAÇÃO Dados físico-químicos podem ser encontrados normalmente nos Handbooks of Data, (manuais de dados). A mais conhecida e usual é a CRC Handbook of Chemistry and Physics, que está na 93ª edição (2012-2013). Muitos desses dados podem ser obtidos on-line. Confira: http://www.hbcpnetbase.com/ A tabela abaixo foi obtida on-line. Procure-a!
Download