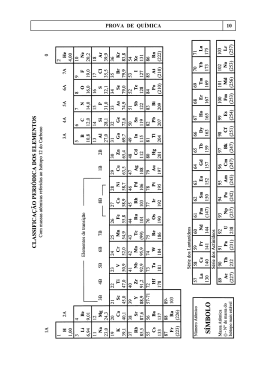
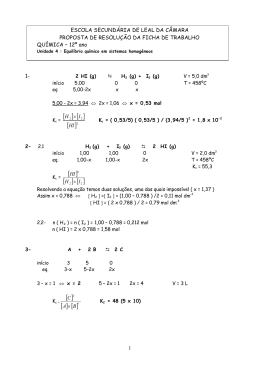
ESTEQUIOMETRIA Cálculo da massa molecular (MM) • Sua unidade é em gramas (g). Procura-se o valor da massa atômica do elemento químico na Tabela Períodica. Ex. H = 1,00g Ca = 40,0g • Se na substância tiver mais de um elemento ou do mesmo elemento, calcula-se somando as massas atômicas destes elementos. Se tiver do mesmo, multiplica-se. Ex. H2SO4 = 2X1 + 1X32 + 4X16 = 98 g Ca3(PO4)2 = 3X40 + 2X31 + 8X16 = 310 CuSO4. 5H2O = ? MOL • O mol sempre indica: quantidade de matéria, massa ou volume. • A quantidade é um número muito grande que foi determinado experimentalmente, o Número de Avogadro (6,02.1023). • O mol também indica massa. É a mesma massa que encontramos na Tabela Periódica, porém em gramas (g). portanto um mol de uma substância é igual à sua massa atômica. • O mol indica volume nas CNTP, que quer dizer condições normais de temperatura e pressão. • A temperatura deve ser 0°C ou 273K e a pressão 1 atm. • Se estas condições forem satisfeitas, um mol de um gás será 22,4L. Estado Gasoso • Se o gás não estiver nas CNTP, pode se calcular através da seguinte fórmula para gases ideiais: • P.V = n. R. T • Onde: P = pressão (atm) V = volume (L) n = número de mols R = constante de Clapeyron = 0,082 atm.L/mol.K T = temperatura (K) • Estequiometria da Reação Química Para estes cálculos, pode-se seguir alguns passos: - Ler no problema o que pede; - Acertar os coeficientes estequiométricos; - Contagem de mol de cada substância; - Relacionar as grandezas; - Calcular com regra de três (proporção). • É sempre importante relacionar as substâncias que tem dados e a substância que se deseja calcular alguma grandeza. Cálculo de Pureza Este cálculo é muito utilizado nos laboratórios químicos, já que nenhuma substância é 100% pura. Sempre há alguma impureza. Por este motivo, alguns problemas já indicam a quantidade de impureza ou o quanto a substância é pura. • Se uma amostra de 40g de NaOH é 70% pura, quanto de NaOH há na amostra? 40g ------100% xg ------- 70% então existem 28g de NaOH na amostra. Cálculo de Rendimento • • • • Nenhuma reação química tem 100% de aproveitamento. Geralmente a quantidade de produto pode ser inferior ao valor esperado. Neste caso, o rendimento não foi total. Isto pode acontecer por várias razões, como por exemplo, má qualidade dos aparelhos ou dos reagentes, falta de preparo do operador, etc. • O cálculo de rendimento é feito relacionando o valor esperado e o valor obtido de produto. Ex: • Numa determinada reação química deve-se obter 500g. Porém, a reação só teve 60% de rendimento. Qual o valor da massa obtida de produto? 100 % – 500g 60% – x (g) x = 300g
Download