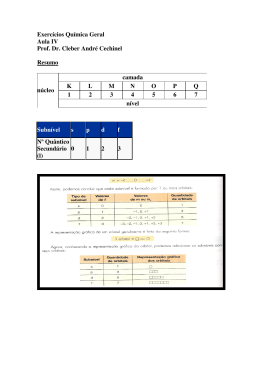
O PRINCÍPIO DA INCERTEZA: HEISENBERG Orbital: a região de máxima probabilidade de se encontrar o elétron no átomo. •Números quânticos: códigos matemáticos associados à energia do elétron Números quânticos • A caracterização de cada elétron no átomo é feita por quatro números quânticos: principal, secundário (ou azimutal), magnético e spin. Num mesmo átomo não existem dois elétrons com os mesmos números quânticos. Principal (n) • Indica o nível de energia do elétron. n = 1, 2, 3, … 7 Secundário (l) • Está associado ao subnível de energia do elétron. Magnético (m) • Está associado à região de máxima probabilidade de se encontrar o elétron, denominada orbital. • Cada orbital comporta no máximo 2 elétrons e é representado graficamente por • Os orbitais estão relacionados com os subníveis; por esse motivo, os valores de m variam de –l a +l. Magnético (m) Espacialmente, os orbitais s apresenta o seguinte aspecto: Espacialmente, os orbitais p apresenta o seguinte aspecto: http://www.youtube.com/watch?v=VfBcfYR1VQo Acesse o link e observe o esquema dos orbitais “s” e “p” Spin (s ou ms) • Está relacionado à rotação do elétron. • Esse número quântico é utilizado para distinguir os elétrons de um mesmo orbital. • A um deles atribui-se arbitrariamente o valor +1/2 e ao outro, o valor –1/2. Spin (s ou ms) • A representação gráfica dos elétrons num mesmo orbital pode ser feita de duas maneiras: Adotaremos como convenção particular que o primeiro elétron de um orbital será representado por uma seta para cima (↑), e o valor de seu spin será –1/2. DISTRIBUIÇÃO ELETRÔNICA EM ORBITAIS • Essa distribuição deve ser feita de acordo com dois conceitos: Vejamos alguns exemplos de distribuição com a atribuição dos quatro números quânticos ao elétron de maior energia. • Exemplo 1 Vejamos alguns exemplos de distribuição com a atribuição dos quatro números quânticos ao elétron de maior energia. • Exemplo 2
Download