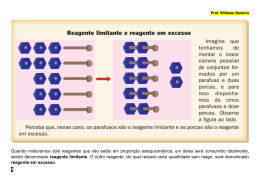
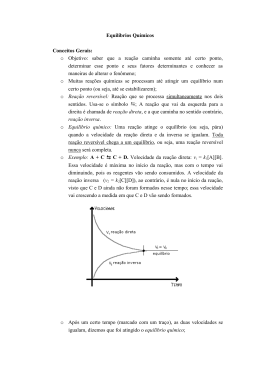
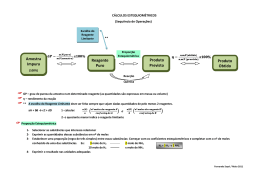
QQ04 CURSO E COLÉGIO Resposta: a) Zn(s) CURSO E COLÉGIO + CuSO4(aq) ZnSO4(aq) + Cu(s) Ou Zn(s) + Cu 2+ Zn +2 + Cu(s) b) Como a proporção estequiométrica da reação é 1:1, seria necessário a mesma 2+ quantidade, em mol de Zn(s) e Cu para que não houvesse reagente em excesso, contudo vemos no experimento 3 que há uma maior quantidade em mols de Zn(s) em 2+ 2+ relação aos íons Cu , logo podemos afirmar que o Cu presente na solução de CuSO4(aq) é o reagente limitante. c) X = 0,5 mols e Y = 0,5 mols. Como a quantidade de matéria total é igual a 1 e a proporção estequiométrica da reação é 1:1, essa quantidade equimolar, permite a maior quantidade de produto formado e portanto a maior energia liberada, acarretando em um maior aumento de temperatura.
Download