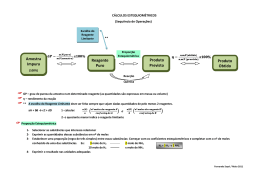
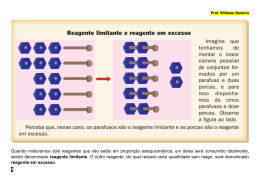
6ª LISTA DE EXERCÍCIOS DE ESTEQUIOMETRIA INDUSTRIAL 1. Quatro gramas de hidróxido de sódio (NaOH) são adicionados a 4 g de ácido clorídrico (HCl), produzindo cloreto de sódio (NaCl) e água. Pergunta-se: há excesso de qual reagente? Qual é a massa em excesso? 2. H2S reage com SO2 segundo a reação: H2S + SO2 → S + H2O. Qual é o número máximo de mols de enxofre que pode ser formado quando se faz reagir 5 mols de H2S com 2 mols de SO2? 3. Doze gramas de ferro (Fe) e 4 g de enxofre (S) são aquecidos até reação total. Levando em conta que o produto obtido é o sulfeto ferroso (FeS), qual dos dois reagentes foi posto em excesso? 4. Calcule o máximo de massa de água que se pode obter partindo de 8 g de hidrogênio e 32 g de oxigênio. Indique qual é o reagente em excesso e quanto sobra do mesmo 5. Amônia gasosa pode ser preparada pela seguinte reação: CaO(s) + NH4Cl(s) → NH3(g) + H2O(g) + CaCl2(s) Se 112 g de óxido de cálcio e 224 g de cloreto de amônia forem misturados, calcule a quantidade máxima, em gramas, de amônia que será produzida. 6. Considere a reação em fase gasosa: N2 + 3 H2 → 2 NH3 Fazendo-se reagir 4 litros de N2 com 9 litros de H2 em condições de pressão e temperatura constantes, é possível afirmar que um composto está em excesso. Qual deles é esse composto? 7. As chamas do oxiacetileno são usadas para soldas, atingindo temperaturas próximas a 2000ºC. Estas temperaturas são devidas a combustão do acetileno com oxigênio: C2H2 + O2 → CO2 + H2O Partindo-se de 125 g de ambos, determine: a) Quem é o reagente limitante e quem é o reagente em excesso. b) Se a reação tiver um rendimento de 85%, qual a massa de CO2, que será formada?
Download