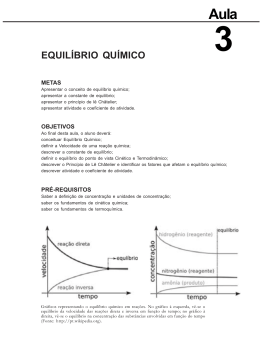
Pré – Exame Química ▪ Sistemas Materiais ▪ Separação das Misturas ▪ Propriedades Periódicas ▪ Ligação Iônica Características: Estrutura iônica do Cloreto de Sódio METAL + AMETAL Metal = doador de elétrons Ametal = receptor de elétrons • Grande diferença de eletronegatividade • Cátion + Ânion • Atração eletrostática Propriedades: Sólidos Cristalinos Elevados Pontos de Fusão e Ebulição Conduzem a Corrente Elétrica no estado líquido ▪ Ligação Covalente Características: AMETAL + AMETAL • • Compartilhamento de pares de elétrons 1 par entre os átomos = ligação simples 2 pares entre os átomos = ligação dupla 3 pares entre os átomos = ligação tripla • Ligação Apolar átomos iguais. Ex: H2, Cl2, O2 Ligação Polar: átomos diferentes. Ex: HCl, H2O, CO2 • ▪ Forças Intermoleculares Ligações de Hidrogênio • • • Compostos com elevados PF e PE. Menos voláteis. Maior tensão superficial Forças de van der Waals • • Dipolo Permanente – moléculas polares Forças de London – moléculas apolares ▪ Oxidação e Redução : Ocorre aumento do Nox Redutor : Ocorre diminuição do Nox Oxidante ▪ Termoquímica ▪ Cinética Química Colisão Efetiva: Alta energia cinética Posição favorável suficiente energia de ativação Fatores que alteram a velocidade: Superfície de Contato Temperatura Catalisador Concentração dos Reagentes entalpia Complexo Ativado produtos Hp Energia de ativação Hr reagentes caminho da reação Lei da Ação das Massas: aA(g) + bB(g) cC(g) V = k . [A]a. [B]b “A velocidade da reação é diretamente proporcional à concentração dos reagentes” ▪ Equilíbrio Químico Reação Reversível: aR bP Rendimento da reação Situação de Equilíbrio químico: 1. As velocidades direta e inversa ficam iguais. 2. As concentrações de reagentes e produtos ficam constantes. 3. A reação não pára. Equilíbrio Dinâmico. Constante de Equilíbrio Deslocamento do Equilíbrio Químico Temperatura Lado Endotérmico Pressão Lado Menor Volume Concentração Lado Oposto velocidade Equilíbrio Químico veloc. direta vdi= v veloc. inversa tempo A Temperatura altera o valor da Constante ▪ Funções Orgânicas OH HIDROCARBONETOS ALIFÁTICOS E AROMÁTICOS H OH O ALDEÍDO O ÉSTER ÉTER CETONA N N O OH O O FENOL ÁLCOOL O AMIDA N N H AMINA O ÁC. CARBOXÍLICO
Download