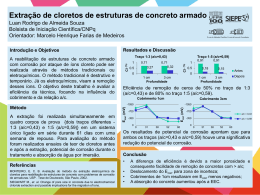
UNIVERSIDADE SÃO FRANCISCO João Paulo Murolo RA: 002200300475 – 10º semestre ANÁLISE DO DESEMPENHO DE INIBIDOR DE CORROSÃO NA ARMADURA DE ESTRUTURAS DE CONCRETO Itatiba 2007 1 João Paulo Murolo RA: 002200300475 – 10º semestre ANÁLISE DO DESEMPENHO DE INIBIDOR DE CORROSÃO NA ARMADURA DE ESTRUTURAS DE CONCRETO Projeto de Pesquisa apresentado à disciplina Trabalho de Conclusão de Curso, do Curso de Engenharia Civil, sob orientação da Profa. Dra. Neide A. Mariano, como exigência para a conclusão do curso de graduação. Itatiba 2007 2 MUROLO, João Paulo. “Análise do desempenho de inibidor de corrosão na armadura de estruturas de concreto”. Trabalho de Conclusão de Curso defendido e aprovado na Universidade São Francisco em 11 de Dezembro de 2007 pela banca examinadora constituída pelos professores: Profa. Dra. Neide A. Mariano USF – Orientadora Prof. Dr. Alberto Luiz Francato USF - Examinador Profa. Maira de Lourdes Rezende USF - Examinadora 3 Aos meus pais e minha irmã. 4 AGRADECIMENTOS À Deus por estar sempre comigo. Aos meus pais por terem me proporcionado à realização dessa graduação, por confiarem em mim e por sempre estarem do meu lado em todos os momentos. À minha irmã que sempre me ajudou com sua experiência na Engenharia Civil tirando minhas dúvidas. À minha namorada Maria Beatriz que teve muita paciência nesse período e que sempre foi muito dedicada a mim, me dando sempre muito apoio e força em tudo. Aos amigos de turma, em especial Ednéia, Fábio, Daniela, Adriana e Edson pela grande amizade que levarei por toda a minha vida e que sem eles a graduação não teria sido tão especial. À minha orientadora Dra. Neide A. Mariano, por ter me convidado a participar do programa de Iniciação Científica da USF, que entre outros, adquiri também experiência para o desenvolvimento desse trabalho, pela orientação do mesmo, por estar sempre disposta a estender a mão e por ser responsável por parte do meu crescimento profissional. Ao técnico de laboratório Baptista por ajudar na preparação das amostras e à técnica Juliana por ajudar com os cálculos das soluções dos ensaios. À Lídia Yukiko Komatsu pelo apoio e força. Ao professor Adão Marques orientador da disciplina do TCC, por ter contribuído na orientação desse trabalho. À todos os professores das disciplinas da Engenharia Civil por serem responsáveis por tudo o que aprendi na graduação. À Universidade São Francisco. Aos meus amigos e aos meus familiares por fazerem parte da minha vida e por estarem sempre ao meu lado. 5 Digno de admiração é aquele que tendo tropeçado ao dar o primeiro passo, levanta-se e segue em frente. (Carlos Fox) 6 MUROLO, João Paulo. Análise do desempenho de inibidor de corrosão na armadura de estruturas de concreto. 2007. Trabalho de Conclusão de Curso (Título de Engenheiro Civil) – Curso de Engenharia Civil da Unidade Acadêmica da Área de Ciências Exatas e Tecnológicas da Universidade São Francisco. RESUMO Dentre as patologias encontradas no concreto armado, a corrosão da armadura se mostra como uma das mais freqüentes e também entre as que envolvem maior comprometimento das estruturas, resultando em altos custos de manutenções e reparos em obras. Por isso, estudos de medidas que retardem os processos corrosivos se mostram necessários e de grande importância. Sendo assim, neste trabalho, os inibidores de corrosão nitrito de sódio e benzoato de sódio foram testados com o objetivo de avaliar seus desempenhos como inibidores da corrosão na armadura (aço carbono CA 50) de estruturas de concreto. Foram realizados ensaios de corrosão, utilizando as técnicas de ensaio por imersão e polarização potenciodinâmica, em uma solução sintética que simula a água de poro do concreto. Para aumentar a agressividade do meio, os ensaios de corrosão também foram realizados em solução sintética de água de poro do concreto adicionado com 3,5% de cloreto de sódio. Os inibidores foram acrescentados separadamente em diferentes concentrações a essa solução. Os resultados demonstraram que os inibidores estudados diminuíram a taxa de corrosão no aço. A eficiência de inibição da corrosão devido ao nitrito de sódio na concentração de 1,0% em massa foi de 98%, próxima daquelas correspondentes a 0,5% em massa de nitrito de sódio (eficiência de 95%) e 2% em massa de benzoato de sódio (eficiência de 97%). A concentração de 0,5% em massa de nitrito de sódio apresentou eficiência superior das obtidas nas concentrações de 2,0% em massa do mesmo inibidor, assim como na concentração de 1% do benzoato de sódio. Esses resultados demonstram que é possível empregar nesse aço o nitrito de sódio na concentração de 0,5% em massa, ao invés de 1%, que é a concentração empregada em obras que usam inibidores contra a corrosão. Palavras-chave: CORROSÃO, INIBIDOR DE CORROSÃO, AÇO CARBONO CA 50, POLARIZAÇÃO POTENCIODINÂMICA, ÁGUA DE PORO. 7 ABSTRACT Among the pathologies found in the reinforced concrete, the corrosion of the steel reveals itself as one of the most frequent and also with bigger compromising of the structures, resulting in high cost of maintenance and repairs in the buildings. That’s why it is necessary and extreme important studies of measures which impede the corrosive processes. So, in this work, corrosion inhibitors: sodium nitrite and sodium benzoate were tested with the objective of evaluating their performances as corrosion inhibitors in the steel (carbon steel CA 50) of a concrete structure. Tests of corrosion were accomplished, using techniques of testing by immersion and potentiodynamics polarization in a synthetic solution that simulates the concrete water of pore. To increase the aggressiveness of the environment, the tests of corrosion were also accomplished in a synthetic solution of the concrete water of pore. The inhibitors were added separately in different concentrations to this solution. The results have demonstrated that the inhibitors studied have diminished the corrosion rate in the steel. The efficiency of the corrosion inhibition due to the sodium nitrite in 1% in mass concentration was 98%, next to those correspondent to 0,5% in mass of sodium nitrate (efficiency of 95%) and 2% in mass of sodium benzoate (efficiency of 97%). The concentration of 0,5% in mass of sodium nitrate has presented a superior efficiency of the ones obtained with concentrations of 2,0% in mass of the same inhibitor as well as with concentration of 1% of sodium benzoate. These results have demonstrated that it is possible to employ the sodium nitrate in this steel with concentration of 0,5% in mass instead of 1% that is the concentration employed in buildings that use inhibitors against corrosion. Key-words: CORROSION, CORROSION INHIBITORS, POTENTIODYNAMICS POLARIZATION, WATER OF PORE. CARBON STEEL CA 50, 8 SUMÁRIO LISTA DE FIGURAS LISTA DE TABELAS LISTA DE SIGLAS 1. INTRODUÇÃO.......................................................................................................................16 2. OBJETIVO.............................................................................................................................17 3. REVISÃO BIBLIOGRÁFICA..................................................................................................18 3.1 Aços-carbono para estruturas.........................................................................................18 3.2 Generalidades da corrosão.............................................................................................21 3.3 Corrosão de armaduras em concreto..............................................................................22 3.4 Corrosão da armadura causada por cloretos..................................................................26 3.5 Corrosão da armadura causada por carbonatação.........................................................29 3.6 Efeitos da corrosão e sintomatologia típica nas estruturas de concreto.........................31 3.7 Água de poro do concreto...............................................................................................37 3.8 Inibidores de corrosão.....................................................................................................38 3.8.1 Nitrito de sódio e benzoato de sódio.......................................................................40 4. MATERIAIS E MÉTODOS.....................................................................................................42 4.1 Matéria prima...................................................................................................................42 4.2 Caracterização microestrutural........................................................................................43 4.3 Ensaios de corrosão........................................................................................................44 4.3.1 Preparação dos meios............................................................................................44 4.3.2 Ensaios de imersão................................................................................................45 4.3.2.1 Preparação dos corpos de prova...................................................................45 4.3.2.2 Equipamentos e acessórios...........................................................................46 4.3.2.3 Técnica do ensaio..........................................................................................46 4.3.3 Ensaios eletroquímicos de corrosão.......................................................................47 4.3.3.1 Preparação dos corpos de prova...................................................................47 4.3.3.2 Equipamentos e acessórios...........................................................................48 4.3.3.3 Curvas de polarização potenciodinâmica......................................................49 9 5. RESULTADOS E DISCUSSÕES..........................................................................................52 5.1 Caracterização microestrutural........................................................................................52 5.2 Ensaios de imersão.........................................................................................................53 5.3 Ensaios eletroquímicos de corrosão................................................................................61 6. CONCLUSÕES......................................................................................................................68 REFERÊNCIAS BIBLIOGRÁFICAS...........................................................................................69 10 LISTA DE FIGURAS Figura 1. Gráfico relacionando corrosão e composição para aços estruturais. (CHIAVERINI, 1990)..........................................................................................................19 Figura 2. Tipos de corrosão e fatores que as provocam. (CASCUDO, 1997)...................22 Figura 3. Formação de pilha em concreto armado. (ALVIM apud MENNUCI, 2006)........23 Figura 4. Diagrama de Pourbaix para o sistema Fe-H2, a 25°C, delimitando os domínios de corrosão, passivação e imunidade. (POURBAIX e HELENE apud MENNUCI, 2006)..................................................................................................................................24 Figura 5. Modelo de vida útil proposto por Tuutti. (TUUTTI apud CASCUDO, 1997)........25 Figura 6. Formas de ocorrência de íons-cloreto na estrutura do concreto. (CASCUDO, 1997)..................................................................................................................................27 Figura 7. Esquema mostrando a corrosão por pite na qual os CL- despassivam a armadura, formam o complexo transitório e depois são reciclados para novas reações. (CASCUDO, 1997).............................................................................................................28 Figura 8. Representação esquemática do processo de carbonatação. (Cascudo, 1997)..................................................................................................................................30 Figura 9. Grau de carbonatação em função da umidade relativa do ambiente. (CASCUDO, 1997).............................................................................................................30 Figura 10. Parte da estrutura de concreto armado que desabou de uma passarela de acesso ao Forte dos Reis Magos em Natal – RN. (CASCUDO, 1997)..............................31 Figura 11. Esforços produzidos que levam à fissuração e destacamento do concreto, devidos à corrosão de armaduras. (CASCUDO, 1997).....................................................32 Figura 12. Fissuras “desenhando” perfeitamente a viga de concreto armado e seguindo o traçado das armaduras principais, em uma das fachadas (lado direito da foto) de um edifício residencial em Araçatuba – SP. (CASCUDO, 1997).............................................33 11 Figura 13. Lascamento do concreto devido às forças de expansão dos produtos de corrosão. (HELENE, 1986).................................................................................................33 Figura 14. Vista de um pilar com destacamento do cobrimento e perda de seção de concreto, apresentando flambagem da armadura longitudinal. (CASCUDO, 1997)..........34 Figura 15. Laje com corrosão de armaduras, cuja sintomatologia típica é o manchamento sem a ocorrência de fissuras (CASCUDO, 1997)..............................................................35 Figura 16. Detalhe da estrutura de concreto armado de uma plataforma de pesca no litoral do Rio Grande do Sul, salientando elevadas perdas de massa das armaduras, excessivo manchamento e altíssimo grau de deterioração do concreto. (CASCUDO, 1997)..................................................................................................................................35 Figura 17. Deterioração típica de “pé” de pilar com destacamento do concreto de cobrimento e exposição das armaduras. (CASCUDO, 1997)............................................36 Figura 18. Deterioração progressiva devida à corrosão das armaduras do concreto. (SHAFFER, 1971)..............................................................................................................37 Figura 19. Barra do aço carbono CA 50 ilustrando a matéria prima utilizada para o estudo.................................................................................................................................42 Figura 20. Seqüência ilustrativa da preparação dos corpos de prova para a caracterização microestrutural...........................................................................................44 Figura 21. Seqüência ilustrativa da preparação dos corpos de prova para os ensaios de imersão...............................................................................................................................46 Figura 22. Seqüência ilustrativa da preparação dos corpos de prova para os ensaios eletroquímicos de corrosão................................................................................................48 Figura 23. Equipamentos utilizados para a realização dos ensaios eletroquímicos..........49 Figura 24. Célula eletroquímica utilizada para os ensaios eletroquímicos........................49 12 Figura 25. Curva de polarização anódica potenciodinâmica padrão do aço inoxidável. (CASCUDO, 1997).............................................................................................................50 Figura 26. Curvas de polarização potenciodinâmica e extrapolação das retas de Tafel para determinação do potencial de corrosão (Ecorr) e da densidade de corrente de corrosão (icorr). (Souza, 2005).............................................................................................51 Figura 27. Micrografias do aço carbono CA50. a) Seção longitudinal com ampliação de 200x; b) Seção transversal com ampliação de 200x; c) Seção longitudinal com ampliação de 500x; d) Seção transversal com ampliação de 500x; e) Seção longitudinal com ampliação de 800x; f) Seção transversal com ampliação de 800x....................................52 Figura 28. Fotos das amostras do aço carbono CA 50 após ensaios de imersão. a) Amostra 1; b) Amostra 2; c) Amostra 3; d) Amostra 4; e) Amostra 5; f) Amostra 6; g) Amostra 7...........................................................................................................................54 Figura 29. Micrografias da amostra 1 após ensaio de imersão em água de poro. a) Ampliação de 50x; b) Ampliação de 200x; c) Ampliação de 500x; d) Ampliação de 200x....................................................................................................................................55 Figura 30. Micrografias da amostra 2 (Referência) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 200x; c) Ampliação de 200x; d) Ampliação de 200x....................................................................................................................................56 Figura 31. Micrografias da amostra 3 (0,5% nitrito de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 200x......................................................................57 Figura 32. Micrografias da amostra 4 (1,0% nitrito de sódio) após ensaio de imersão. a) Ampliação de 100x; b) Ampliação de 500x....................................................................57 Figura 33. Micrografias da amostra 5 (2,0% nitrito de sódio) após ensaio de imersão. a) Ampliação de 100x; b) Ampliação de 500x....................................................................57 Figura 34. Micrografias da amostra 6 (1,0% benzoato de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 500x......................................................................58 13 Figura 35. Micrografias da amostra 7 (2,0% benzoato de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 500x......................................................................58 Figura 36. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro (Solução 1) após 4 dias de imersão e em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência)...........................................................................................61 Figura 37. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 0,5% de nitrito de sódio (Solução 3).......................................63 Figura 38. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 1,0% de nitrito de sódio (Solução 4).......................................63 Figura 39. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 2,0% de nitrito de sódio (Solução 5).......................................64 Figura 40. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 1,0% de benzoato de sódio (Solução 6).................................65 Figura 41. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 2,0% de benzoato de sódio (Solução 7).................................65 Figura 42. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em soluções conforme indicadas na Tabela 5.........................................................................66 14 LISTA DE TABELAS Tabela 1. Propriedades mecânicas exigíveis de barras e fios de aço destinados à armadura para concreto armado. (MAMEDE, 1999).........................................................20 Tabela 2. Conteúdo de cloretos limite proposto por diversas normas (% em relação à massa de cimento). (CASCUDO, 1997)............................................................................29 Tabela 3. Composição química nominal do aço carbono CA 50 (% de peso)...................42 Tabela 4. Componentes da solução da água de poro do concreto em g/l de água destilada. (Barneyback e Diamond apud Miranda et al, 1990)..........................................44 Tabela 5. Meios empregados nos ensaios de imersão e eletroquímicos de corrosão.............................................................................................................................45 Tabela 6. Valores das perdas de massa e das taxas de corrosão das amostras do aço carbono CA 50 para cada solução dos ensaios de imersão..............................................60 Tabela 7. Valores dos potenciais de corrosão (Ecorr) e densidades de corrente de corrosão (icorr) obtidos a partir das curvas de polarização potenciodinâmica e valores das eficiências dos inibidores...................................................................................................67 15 LISTA DE SIGLAS PIB – Produto Interno Bruto ABNT – Associação Brasileira de Normas Técnicas CA 50 – Aço para armadura de concreto armado com tensão mínima de escoamento de 50 kgf/mm² Ecorr – Potencial de corrosão Icorr – Densidade de corrente de corrosão NBR – Norma Brasileira ASTM – American Society for Testing and Materials Epp – Potencial passivo primário Ic – Densidade de corrente elétrica ASM – American Society for Metals mpy – Milésimo polegada por ano 16 1. INTRODUÇÃO Entre os materiais de construção, como é do conhecimento geral, o aço tem uma posição de relevo: combina resistência mecânica, trabalhabilidade, disponibilidade e baixo custo. Assim sendo, é fácil compreender a importância e a extensão da aplicação dos aços em todos os campos da engenharia civil. Com exceção da resistência à corrosão, todos os outros requisitos são satisfeitos em maior ou menor grau pelos aços-carbono, obtidos por laminação. A corrosão de armaduras em estruturas de concreto apresenta-se como um dos problemas de maior grau no contexto da patologia das construções. Atualmente é crescente e de certa forma relevante a mobilização de vários segmentos da engenharia civil no sentido de combater este fenômeno tão danoso e que tantos prejuízos econômicos traz para a sociedade de uma forma geral. Os custos oriundos da corrosão na maioria dos países industrializados são em torno de 2-4% do produto interno bruto (PIB) (SASTRI apud MENNUCI, 2006). Considerando estes custos na construção civil, medidas de proteção que retardem os processos corrosivos resultam em economia a longo prazo, já que a prevenção compensa o investimento inicial. No entanto, existe uma tendência mundial ao uso de adições e aditivos no preparo do concreto com a finalidade de aumentar a durabilidade e consequentemente a vida útil das estruturas. Entre os aditivos que vêm sendo utilizados, podemos citar os inibidores de corrosão. O trabalho desenvolvido analisou o desempenho dos inibidores de corrosão nitrito de sódio e o benzoato de sódio em diferentes concentrações no aço carbono CA 50, amplamente utilizado em estruturas de concreto armado, em meio simulando o interior dos poros do concreto. Contudo, foram realizados ensaios de caracterização microestrutural, para o melhor conhecimento da microestrutura do aço, ensaios de imersão, para análise da perda de massa devido à corrosão, das superfícies das amostras e da taxa de corrosão e ensaios eletroquímicos de corrosão, através da técnica de polarização potenciodinâmica, a qual permitiu obter os parâmetros potencial de corrosão, Ecorr e densidade de corrente de corrosão, icorr. 17 2. OBJETIVO O trabalho desenvolvido teve como objetivo analisar o desempenho de inibidores de corrosão, especificamente o nitrito de sódio e o benzoato de sódio na armadura de estruturas de concreto (aço carbono CA 50) e assim poder avaliar a implementação desse material em tais estruturas, com a finalidade de aumentar suas vidas úteis, diminuir a necessidade de serviços de intervenção e recuperação ao longo da vida. 18 3. REVISÃO BIBLIOGRÁFICA 3.1 Aços-carbono para estruturas Os aços-carbono laminados, sem tratamentos térmicos, são muito utilizados como aços estruturais na construção civil (CHIAVERINI, 1990). Os requisitos fundamentais que os aços carbonos estruturais devem obedecer são: • Ductilidade e homogeneidade; • Valor elevado da relação entre limite de resistência e limite de escoamento; • Soldabilidade; • Suscetibilidade de corte por chama, sem endurecimento; • Resistência razoável à corrosão. Com exceção da resistência à corrosão, todos os outros requisitos são satisfeitos em maior ou menos grau pelos aços-carbono, de baixo a médio carbono, obtidos por laminação. Segundo Chiaverini (1990), a resistência à corrosão só é alcançada com adição de pequenos teores de cobre, elemento que, adicionado em teores muito baixos, da ordem de 0,25%, melhora aquela propriedade de mais ou menos duas vezes em relação ao mesmo aço sem cobre. A Figura 1 mostra a relação corrosão e composição para aços estruturais. Para a maioria das aplicações estruturais, o teor de carbono desses aços varia de 0,15% a 0,40%, com os outros elementos (Mn, Si, S) nos teores considerados normais. O aço com carbono e manganês em torno de 0,20% e 0,50% respectivamente, apresenta limite de escoamento de cerca de 24,5 kgf/mm² (245 MPa) e limite de resistência de 42,0 kgf/mm² (410 MPa). (CHIAVERINI, 1990) Nas estruturas, os perfis de aço-carbono utilizados são os mais diversos, sobressaindo-se os seguintes: barras redondas (inclusive as empregadas em concreto armado), quadradas, hexagonais, ovais, barras chatas, cantoneiras, tês, eles, duplos tês, etc. 19 Figura 1. Gráfico relacionando corrosão e composição para aços estruturais. (CHIAVERINI, 1990). Todos esses perfis são produzidos por laminação e empregados nesse estado, geralmente sem qualquer tratamento térmico ou mecânico posterior. Como já foi mencionado, uma das aplicações mais importantes dos aços-carbono estruturais, é em concreto armado. Para esse emprego, os aços-carbono podem ser classificados em (CHIAVERINI, 1990): • Aços de dureza natural, laminados a quente (classe A); • Aços encruados a frio (classe B); • Aços “patenting” (ou patenteados). Ao primeiro grupo (aços de dureza natural) pertencem os aços utilizados na indústria de construção civil, desde há muito tempo classificados pela ABNT nas categorias CA-25 e CA-32, com limites mínimos de escoamento de 25 kgf/mm² (250 MPa) e 32 kgf/mm² (310 MPa) respectivamente. (CHIAVERINI, 1990) O aço CA 50 produzido no Brasil é geralmente utilizado como vergalhão para concreto armado. O diagrama tensão-deformação do material apresenta um nítido patamar de escoamento e grande deformação antes da ruptura, e possui limite de escoamento de 50 kgf/mm² (490 MPa). Em 1972, a ABNT lançou a especificação FB-3 relativa à “barra e fios de aço destinados a armaduras de concreto armado” na qual esses materiais são divididos em 20 cinco categorias – CA 25, CA 32, CA 40, CA 50 e CA 60 (apenas para fios), em que os algarismos indicam as tensões mínimas de escoamento ou de limite convencional n em kgf/mm² (CHIAVERINI, 1990). A Tabela 1, segundo a Norma Brasileira (NBR) 7480, apresenta as propriedades mecânicas exigíveis de barras e fios de aço destinados a armaduras para concreto armado. Tabela 1. Propriedades mecânicas exigíveis de barras e fios de aço destinados à armadura para concreto armado. (MAMEDE, 1999) Ensaio de Ensaio de tração dobramento a (valores mínimos) 180º Aderência Coeficiente Resistência característica Categoria de escoamento fy (MPa) Limite de Diâmetro de pino de (mm) conformação resistência Alongamento fst em 10 φ (MPa) (%) φ < 20 φ ≥ 20 φ ≥ 10 mm superficial mínimo para CA-25 250 1,20 fy 18 2φ 4φ 1,0 CA-50 500 1,10 fy 8 4φ 6φ 1,5 CA-60B 600 1,05 fy 5 5φ - 1,5 Para a maioria das aplicações da engenharia, os aços estruturais devem ter custo moderado e razoável resistência mecânica, requisitos que são atendidos satisfatoriamente pelos aços-carbono comuns. Segundo Chiaverini (1990), para melhores propriedades mecânicas e certa resistência à corrosão atmosférica, são utilizados os chamados “aços de alta resistência e baixo teor em liga” que se caracterizam pela presença em teores relativamente baixos dos elementos de cobre, níquel, cromo e molibdênio principalmente, além da elevação acima das porcentagens normais dos elementos fósforo, silício e manganês, procurando-se manter sempre o teor de carbono a níveis relativamente baixos. 21 3.2 Generalidades da corrosão A corrosão pode ser definida como a interação destrutiva ou a interação que implique inutilização para uso, de um material com o ambiente, seja por reação química, ou por eletroquímica (CASCUDO, 1997). No caso de um metal, segundo Ramanathan (s.d.), o material é convertido a um estado não metálico, quando isto ocorre, o metal perde suas qualidades essenciais tais como resistência mecânica, elasticidade e ductilidade. Cascudo (1997) explica que segundo a natureza do processo, a corrosão pode ser classificada em química e eletroquímica. A primeira também conhecida por corrosão seca ou simplesmente oxidação se dá por uma reação gás metal, com formação de uma película de óxido. É um processo lento e não provoca deterioração substancial das superfícies metálicas, exceto quando se tratar de gases extremamente agressivos. Já a corrosão eletroquímica ou aquosa é a que efetivamente traz problemas às obras civis. Trata-se de um ataque de natureza eletroquímica, que ocorre em meio aquoso, como resultado da formação de uma pilha ou célula de corrosão, com eletrólito e diferença de potencial entre trechos da superfície do aço. O eletrólito forma-se a partir da presença de umidade no concreto. Esse tipo de corrosão suscita um movimento de elétrons ao longo de trechos da armadura e um movimento iônico através do eletrólito. Cascudo (1997) cita que segundo a morfologia, a corrosão das armaduras pode de uma forma geral, ser classificada em generalizada, por pite e sob tensão fraturante e explica cada uma delas conforme a seguir: A corrosão generalizada ocorre de uma maneira generalizada em toda a superfície do metal, podendo ser uniforme, com a superfície tendendo a ser lisa e regular, ou não uniforme, apresentando a superfície rugosa e irregular. A corrosão por pite, também conhecida por corrosão puntiforme, é um tipo de corrosão localizada, no qual há formação de pontos de desgaste definidos na superfície metálica, os quais evoluem aprofundando-se, podendo causar a ruptura pontual da barra. A corrosão por pites será tanto mais intensa e perigosa quanto maior for a relação área catódica/área anódica. Desta forma, podem ocorrer pites com altas taxas de dissolução do ferro, de alta gravidade. A corrosão sob tensão fraturante, que é um outro tipo de corrosão localizada, a qual se dá concomitantemente com uma tensão de tração na armadura, podendo dar origem à propagação de fissuras (fenômeno de natureza transgranular ou intragranular) na estrutura do aço. Os mecanismos que reagem à corrosão sob tensão ainda são poucos compreendidos, mas seus efeitos são reconhecidamente perigosos nas estruturas de concreto, caracterizando-se por rupturas bruscas, sem deformações significativas de 22 elementos estruturais, e praticamente sem sintomas visuais de corrosão. A Figura 2 ilustra os três tipos de corrosão apresentados. Figura 2. Tipos de corrosão e fatores que as provocam. (CASCUDO, 1997) 3.3 Corrosão de armaduras em concreto Segundo Cascudo (1997), a corrosão de armaduras em concreto é um caso específico de corrosão eletroquímica em meio aquoso, em que o eletrólito apresenta características de resistividade elétrica consideravelmente mais altas do que as dos eletrólitos típicos (meio aquoso comum, não confinado a uma rede de poros, como é o caso do concreto). Wolynec apud Mennuci (2006) explica que a corrosão eletroquímica representa uma situação em que duas ou mais reações eletroquímicas ocorrem simultaneamente, de forma espontânea, sendo pelo menos uma de natureza anódica e outra catódica. Essas reações promovem a formação de pilhas eletroquímicas, que ocorrem em regiões de um mesmo metal, no caso deste estudo, a armadura no interior do concreto (CASCUDO, 2000), como mostra a Figura 3. 23 Figura 3. Formação de pilha em concreto armado. (ALVIM apud MENNUCI, 2006) A armadura encontra-se no interior do concreto em meio altamente alcalino (pH em torno de 12,5). Esta alcalinidade provém da fase líquida constituinte dos poros do concreto, a qual nas primeiras idades, basicamente é uma solução saturada de hidróxido de cálcio, Ca(OH)2, sendo esta oriunda das reações de hidratação do cimento. Em idades avançadas o concreto continua, via de regra, propiciando um meio alcalino, sendo que sua fase líquida, neste caso, é uma solução composta principalmente por hidróxido de sódio (NaOH) e hidróxido de potássio (KOH) originários dos álcalis do cimento. (CASCUDO, 1997) As condições de pH e potencial, nas quais o ferro, principal elemento de liga do aço, pode sofrer corrosão, ficar passivo ou inerte, foram determinadas por Pourbaix (1974), e são indicadas no clássico diagrama de equilíbrio potencial-pH, para o sistema ferro/água a 25°C, ilustrado pela Figura 4. Segundo Mennuci (2006), este diagrama tem sido usado como boa aproximação para o sistema do aço carbono embebido no concreto, considerando-se o pH da água presente nos poros do concreto. 24 Figura 4. Diagrama de Pourbaix para o sistema Fe-H2, a 25°C, delimitando os domínios de corrosão, passivação e imunidade. (POURBAIX e HELENE apud MENNUCI, 2006) Mennuci (2006) explica que se observa neste diagrama que para os valores de pH típicos da água de poro, nos períodos iniciais após a fabricação do concreto armado, e, para os valores de potencial típicos do ferro embebido no concreto, o ferro encontra-se no estado passivo. Dessa forma, a armadura presente no interior do concreto, em meio alcalino, está protegida do fenômeno da corrosão, devido à presença de uma capa ou película protetora de caráter passivo, que envolve essa armadura, e é chamada de proteção química. O filme passivo é muito aderente ao aço e bastante delgado (normalmente invisível), cuja espessura varia de 10-3 a 10-1 µm. É composto por óxido de ferro, e este é formado rapidamente a partir das reações de oxidação do ferro e de redução do oxigênio inicialmente presente na fase líquida dos poros do concreto, apresentando uma variação de composição que vai do Fe3O4 ao –Fe2O3. (CASCUDO,1997) Sagoe-Crentsil & Glasser apud Cascudo (1997) destacam ainda um estado de semipassivação, o qual representa melhor o real estado da maioria das estruturas de concreto. Segundo eles, a proteção química do aço nesse estado apresenta uma estrutura interfacial dupla, constituída por uma camada mais interna de óxido de ferro e uma camada mais externa que é uma mistura de goetita (αFeOOH) e óxido de ferro. Ainda a respeito da película de passivação, Helene apud Cascudo (1997) ressalta que ela pode ser resultante 25 da combinação da ferrugem superficial (Fe(OH)3), com o hidróxido de cálcio, formando o ferrato de cálcio. Cascudo (1997) diz que no estado de passivação a corrosão não é exatamente nula, mas é severamente limitada pela resistência ôhmica do filme. Destaca que a taxa de corrosão passiva do aço no concreto é equivalente à dissolução ou oxidação de cerca de 0,1 µm/ano da superfície do aço, o que é considerado desprezível em termos de vida útil para as estruturas de concreto. Pode-se, portanto, afirmar sem receios que enquanto a armadura estiver passivada, não haverá corrosão, posto que a película impede o acesso de umidade, oxigênio e agente agressivos à superfície do aço, bem como dificulta a dissolução do ferro. A fim de expor todo o mecanismo da corrosão do aço no concreto, adotar-se-á o modelo de corrosão proposto por Tuutti apud Cascudo, 1997 que divide o processo em iniciação e propagação, ilustrado pela Figura 5. A iniciação corresponde ao período de tempo que vai desde a execução da estrutura até a ação do agente agressivo em atravessar o concreto de cobrimento, alcançar a armadura e despassivá-la. A propagação, por sua vez, consiste no desenvolvimento da corrosão até que se alcance um grau inaceitável do processo. (CASCUDO, 1997) Figura 5. Modelo de vida útil proposto por Tuutti. (TUUTTI apud CASCUDO, 1997) Como demonstrado anteriormente, a película passiva é a grande defesa da armadura e a garantia de que esta não sofrerá corrosão. Segundo Cascudo (1997), entretanto ela pode ser perdida, descaracterizando-se, frente a duas condições básicas: 1. Presença de uma quantidade suficiente de íons cloreto; as quais podem advir tanto do meio externo e atingir a armadura por difusão, quanto podem já estar no interior 26 do concreto devido à água de amassamento e/ou a agregados contaminados, ou mesmo devido à presença de aditivos aceleradores de pega e endurecimento à base de cloreto de cálcio (CaCl2); 2. Diminuição da alcalinidade do concreto; isto pode se dar devido principalmente às reações de carbonatação ou mesmo devido à penetração de substâncias ácidas no concreto. Em casos especiais, a queda na alcalinidade pode ser oriunda da lixiviação do concreto, em que a solução alcalina intersticial é lavada pelo ataque das águas, neste caso, para que ocorra a lixiviação, é necessária certa pressão hidráulica no concreto associada à ação das águas. 3.4 Corrosão na armadura causada por cloretos Nenhum outro contaminante comum está tão extensivamente documentado na literatura como causador de corrosão dos metais no concreto como estão os cloretos. Estes íons podem ser introduzidos intencionalmente no concreto, como agente acelerador de pega e endurecimento, e podem vir através de agregados e água de amassamento contaminados (nestes casos diz-se que eles são incorporados à massa de concreto). Ou podem penetrar por sais anticongelantes (empregados nos invernos rigorosos de países frios), salmouras industriais e maresia ou névoa de ambiente marinho, situação esta bastante comum em nosso país (nestes casos diz-se que a contaminação se deu por impregnação da superfície de concreto pelos agentes agressivos externos). (CASCUDO, 1997) Cascudo (1997) ressalta que os mecanismos de transporte que levam ao movimento e concentração iônica dos cloretos no concreto são os seguintes: absorção capilar, difusão iônica, permeabilidade sob pressão e migração iônica. Segundo Andrade (1992) alguns inconvenientes causados pela presença de altos teores de cloretos no concreto são: 1. Em dias de temperatura ambiente elevada, podem causar um endurecimento do concreto tão rápido na concretagem, que poderá impedir o total enchimento das fôrmas e o acabamento das superfícies; 2. Em casos de cobrimento pouco espesso, podem acelerar o processo de corrosão das armaduras; 3. Podem aumentar a retração do concreto, aumentando a fissuração interna e superficial. 27 Andrade (1992) diz que o tempo que os cloretos demoram até chegar à armadura é denominado “período de iniciação” e este depende principalmente dos seguintes fatores: 1. Concentração de cloretos no meio externo; 2. Natureza do cátion que acompanha o cloreto; 3. Qualidade do cimento (tipo de cimento, relação água/cimento, porosidade, etc.); 4. Temperatura; 5. Abertura e quantidade de fissuras. Sabe-se que o cloreto se apresenta em três formas no concreto: quimicamente ligado ao aluminato tricálcio (C3A), formando cloroaluminato de cálcio ou sal de Friedel (C3A.CaCl2.10H2O), adsorvido na superfície dos poros e sob a forma de íons-livres. Por maior que seja a capacidade de um dado concreto de ligar-se quimicamente ou adsorver fisicamente íons cloreto, haverá sempre um estado de equilíbrio entre as três formas de ocorrência desses íons, de forma que sempre existirá certo teor de Cl- livre na fase líquida do concreto. Esses cloretos livres são os que efetivamente causam preocupação. (CASCUDO, 1997) A Figura 6 ilustra as três possibilidades de ocorrência de Cl-. Figura 6. Formas de ocorrência de íons-cloreto na estrutura do concreto. (CASCUDO, 1997) Cascudo (1997) cita e explica as três teorias modernas conforme a seguir para explicar os efeitos dos íons cloreto sobre a forma de corrosão do aço, das quais, a primeira está explicitamente ligada ao período de iniciação, enquanto as outras duas parecem referirse ao período de propagação da corrosão. 28 Teoria do Filme de Óxido: os íons penetram no filme de óxido passivante sobre o aço, através de poros ou defeitos, mais facilmente do que penetram outros íons. Alternadamente os cloretos podem dispersar-se coloidalmente no filme de óxido, tornando mais fácil a sua penetração. Teoria da Adsorção: os íons Cl- são adsorvidos na superfície metálica em competição com o oxigênio dissolvido ou com íons hidroxila. O cloreto promove a hidratação dos íons metálicos, facilitando a sua dissolução. Teoria do Complexo Transitório: os íons Cl- competem com os íons hidroxila (OH-) para a produção de íons ferrosos pela corrosão. Forma-se então um complexo solúvel de cloreto de ferro. Este pode difundir-se a partir das áreas anódicas destruindo a camada protetora de Fe (OH)2 e permitindo a continuação do processo corrosivo. O processo de corrosão do aço em presença de cloretos é ilustrado na Figura 7. Mennuci (2006) explica que inicialmente, íons cloreto além de umidade e oxigênio, penetram o cobrimento de concreto, atingem a superfície externa do aço, causando a despassivação localizada deste, dando início ao ataque corrosivo nesta região (anódica) que é contrabalançado por reações catódicas nas regiões circunvizinhas (catódicas). Figura 7. Esquema mostrando a corrosão por pite na qual os CL- despassivam a armadura, formam o complexo transitório e depois são reciclados para novas reações. (CASCUDO, 1997) Um ponto bastante polêmico em relação aos cloretos seria sua concentração crítica máxima, abaixo da qual não houvesse despassivação da armadura (MENNUCCI, 2006). A NBR 6118 limita o teor de cloretos presentes na água de amassamento do concreto a 29 500 mg/L. A maioria das normas estrangeiras fixa os teores de Cl- em relação à massa de cimento, conforme a Tabela 2. Tabela 2. Conteúdo de cloretos limite proposto por diversas normas (% em relação à massa de cimento) (CASCUDO, 1997): Normas Teor de Cl- para concreto armado (%) EH – 88 (espanhola) 0,40 Pr EM-206 (espanhola) 0,40 BS-81110/85 (inglesa – British Standard) 0,20 – 0,40* ACI-318/83 (norte americana – American Concrete Institute) 0,15 – 0,30 – 1,00** * O limite varia em função do tipo do cimento; ** O limite varia em função da agressividade ambiental. 3.5 Corrosão da armadura causada por carbonatação A carbonatação é uma reação de neutralização dos hidróxidos presentes no concreto, reduzindo o pH de 12 para 8. Esta reação no pH leva o aço de uma região de estabilidade de produtos de corrosão insolúveis (passivação) para uma região de estabilidade de produtos solúveis (corrosão) (CRIVELARO, 1997), conforme visto na Figura 4. Crivelaro (1997) explica que o CO2 entra no concreto por mecanismo de difusão, devido à diferença de concentração entre o ambiente externo e a água nos poros do concreto, sendo este mecanismo dependente do coeficiente de difusão. Por sua vez, o coeficiente de difusão depende da porosidade, distribuição dos poros, tamanho dos poros, grau de saturação dos poros (grau de umidade), concentração do gás, temperatura ambiente e das interações entre o gás e o concreto. Uma característica do processo de carbonatação é a existência de uma “frente” de avanço do processo, que separa duas zonas com pH muito diferentes; uma com pH menor que 9 (carbonatada) e a outra com pH maior que 12 (não carbonatada). Ela é comumente conhecida por frente de carbonatação e deve sempre ser mensurada com relação à espessura do concreto de cobrimento da armadura. É importante que essa frente não atinja 30 a armadura, sob pena de despassivá-la. A Figura 8 mostra um esquema simplificado do processo de carbonatação. (CASCUDO, 1997) Figura 8. Representação esquemática do processo de carbonatação. (CASCUDO, 1997) Segundo Cascudo (1997), a carbonatação máxima ocorre quando a umidade relativa está entre 50% e 70%, e é insignificante em dois casos: quando a umidade estiver próxima de 100%, porque o acesso de dióxido de carbono fica extremamente reduzido, ou para uma umidade relativa abaixo de 30%, pela falta de água, conforme ilustra a Figura 9. Figura 9. Grau de carbonatação em função da umidade relativa do ambiente. (CASCUDO, 1997) 31 Com a carbonatação, descaracterizada a capa de passivação, o aço se corrói de forma generalizada (Figura 1), tal como se estivesse simplesmente exposto à atmosfera sem qualquer proteção, porém, o agravante de que a umidade permanece no interior do concreto e, portanto, em contato com a armadura muito mais tempo do que se esta estivesse exposta ao ar, já que o concreto absorve umidade muito rapidamente, mas seca bem mais lentamente. (CASCUDO, 1997) 3.6 Efeitos da corrosão e sintomatologia típica nas estruturas de concreto Segundo Cascudo (1997), os produtos de corrosão são uma gama variada de óxidos e hidróxidos de ferro que passam a ocupar, no interior do concreto, volumes de 3 a 10 vezes superiores ao volume original do aço da armadura, podendo causar tensões internas maiores que 15 MPa. À medida que a corrosão vai se processando, esses produtos expansivos vão se acumulando cada vez mais ao redor das armaduras, criando verdadeiras “crostas” no seu entorno. A Figura 10 ilustra esta situação. Figura 10. Parte da estrutura de concreto armado que desabou de uma passarela de acesso ao Forte dos Reis Magos em Natal – RN; é possível observar como é criada uma “crosta” expansiva no entorno da armadura devida à corrosão. (CASCUDO, 1997) Cascudo (1997) explica que tal fato produz esforços no concreto na direção radial das barras, conforme a Figura 11, os quais geram tensões de tração que culminam com a 32 fissuração das peças de concreto. As fissuras obtidas se estabelecem na direção paralela à barra corroída e são classificadas como fissuras ativas progressivas, isto porque têm aberturas que vão aumentando com o decorrer do processo corrosivo. Esta evolução das fissuras implica posterior lascamento do concreto, com comprometimento do monolitismo estrutural (dado pela aderência aço/concreto), e no destacamento da camada de cobrimento, em geral deixando expostas as armaduras. As Figuras 12 e 13 destacam alguns dos sintomas comentados neste parágrafo. Figura 11. Esforços produzidos que levam à fissuração e destacamento do concreto, devidos à corrosão de armaduras. (CASCUDO, 1997) 33 Figura12. Fissuras “desenhando” perfeitamente a viga de concreto armado e seguindo o traçado das armaduras principais, em uma das fachadas de um edifício residencial em Araçatuba – SP; pode-se observar um encontro viga-pilar com revestimento de argamassa removida, mostrando armaduras expostas, corroídas e deformadas. A corrosão neste caso foi oriunda do ataque de cloretos incorporados ao concreto como aditivos aceleradores de pega e endurecimento. (CASCUDO, 1997) Figura 13. Lascamento do concreto devido às forças de expansão dos produtos de corrosão. (HELENE, 1986) Em peças submetidas à flexocompressão, como os pilares, por exemplo, o destacamento do concreto pode significar importante perda de seção do elemento estrutural. Cascudo (1997) ressalta que a transferência de carga para as armaduras, em geral já 34 dessolidarizadas do concreto pela corrosão, resulta na deformação ou flambagem das barras longitudinais das peças estruturais. A Figura 14 ilustra esta ocorrência. Figura 14. Vista de um pilar com destacamento do cobrimento e perda de seção de concreto, apresentando flambagem da armadura longitudinal. (CASCUDO, 1997) Contudo, Cascudo (1997) diz, que nem sempre se produz fissuração quando as armaduras se corroem. Caso o concreto esteja muito úmido, os óxidos são gerados a uma velocidade constante e podem emigrar através da rede de poros, aparecendo na superfície sob a forma de manchas marrom-avermelhadas, que inclusive podem não coincidir com a posição das armaduras. Nesta situação, a durabilidade das estruturas é basicamente afetada pela perda de seção das armaduras e pelo comprometimento à aderência aço/concreto. Em muitos casos, no entanto, ocorre uma situação mista, com a incidência de fissuras contendo manchas em suas bordas. A Figura 15 ilustra um caso de corrosão cujo sintoma básico é o manchamento da superfície de concreto. As Figuras 16 e 17 mostram aspectos sintomatológicos diversos da corrosão das armaduras no concreto. 35 Figura 15. Laje com corrosão de armaduras, cuja sintomatologia típica é o manchamento acentuado sem a ocorrência de fissuras. (CASCUDO, 1997) Figura 16. Detalhe da estrutura de concreto armado de uma plataforma de pesca no litoral do Rio Grande do Sul, salientando elevadas perdas de massa das armaduras, excessivo manchamento e altíssimo grau de deterioração do concreto. (CASCUDO, 1997) 36 Figura 17. Deterioração típica de “pé” de pilar com destacamento do concreto de cobrimento e exposição das armaduras; as heterogeneidades propiciadas pelas regiões enterradas e expostas ao ar do concreto favorecem o estabelecimento de macromoléculas de corrosão. (CASCUDO, 1997) Cascudo (1997) afirma que a corrosão de armaduras deteriora as estruturas de concreto sob duas óticas, de ação simultânea; uma delas diz respeito à perda de seção das barras e seus efeitos, e a outra se refere ao comportamento mecânico de fissuração do concreto e suas conseqüências. Ambos os processo ocorrendo sem que haja uma intervenção na estrutura, fatalmente implicarão desfecho indesejável que é o colapso dessa estrutura. A Figura 18 ilustra esquematicamente a deterioração devida à corrosão das armaduras. 37 Figura 18. Deterioração progressiva devida à corrosão das armaduras do concreto. (SHAFFER, 1971) 3.7 Água de poro do concreto Oliveira (2000) descreve que a água de poro da pasta de cimento, também denominada fase aquosa ou fluido do poro, constitui o meio no qual se dá a hidratação progressiva do cimento e as reações envolvendo os compostos hidratados e os agentes do meio externo. Todas as pesquisas realizadas até o momento demonstram que o estudo da água de poro de pastas e argamassas de cimento revelou-se útil em investigações sobre reação álcali-agregado, durabilidade do concreto em contato com águas e gases agressivos, passivação do aço e corrosão de armadura de concreto armado e protendido, e na hidratação e endurecimento do cimento em presença de adições e aditivos. (OLIVEIRA, 2000) Segundo Oliveira (2000), considera-se a água do poro como a água presente nos poros da pasta de cimento endurecida, apta a reagir com os grãos anidros, com produtos hidratados e com espécies químicas externas que eventualmente penetram no interior da pasta. Na verdade, a água do poro é uma solução de íons cuja composição depende do cimento, da quantidade de água de amassamento, do grau de hidratação do cimento e da interação com o meio externo. Anteriormente, modelava-se essa fase líquida do concreto através de soluções sintéticas, as quais basicamente eram soluções saturadas de hidróxido de cálcio, Ca(OH)2. 38 Barneyback e Diamond apud Miranda et al (1990) no entanto, apontam um outro tipo de solução sintética: NaOH 0,01 N + KOH 0,05 N, como sendo a solução que representa aquela contida nos poros de um concreto envelhecido. (CASCUDO, 1997) 3.8 Inibidores de corrosão Segundo Gentil (1982), inibidor é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. Segundo Andrade (1992), inibidores são substâncias que têm a capacidade de bloquear a atividade da reação anódica, inibidores anódicos, da reação catódica, inibidores catódicos, ou de ambas juntas, inibidores mistos. Substâncias com essas características têm sido muito usadas como um dos melhores métodos para proteção contra a corrosão, e muitas pesquisas, visando à utilização de novos compostos com esse objetivo têm sido desenvolvidas e estimuladas. A eficiência de um inibidor pode ser determinada segundo Gentil (1982) pela Equação (1): Ef = (Ts - Tc) / Ts x 100 (1) Onde: Ef = eficiência em porcentagem Ts = taxa de corrosão sem uso de inibidor Tc = taxa de corrosão com uso de inibidor. No caso específico do concreto os inibidores, como quaisquer outros aditivos, não devem mudar as características do cimento, tais como: resistência, tempo de pega, aderência, retração, ou mesmo provocar expansões. Assim, eles terão que ser compatíveis com o concreto e, como são adicionados à água de amassamento, não precisam de mão de obra especializada, facilitando sua utilização. (Lima, 1996) Gentil (1982) cita as diferentes classificações para os inibidores na composição e no comportamento. Tem-se, então, quanto: 1. Composição: • Orgânicos; 39 • Inorgânicos. 2. Comportamento: • Oxidantes; • Não-oxidantes; • Anódicos; • Catódicos; • Adsorção. Gentil (1982) também explica as seguintes classificações para os inibidores conforme a seguir: Inibidores anódicos: Atuam reprimindo reações anódicas. Os inibidores anódicos retardam ou impedem a reação do anodo e geralmente funcionam reagindo com o produto de corrosão inicialmente formado, ocasionando um filme aderente e extremamente insolúvel, na superfície do metal, ocorrendo a polarização anódica. Substâncias como hidróxidos, carbonatos, silicatos, boratos e fosfatos terciários de metais alcalinos são inibidores anódicos, porque reagem com os íons metálicos Mn+ produzidos no anodo, formando produtos insolúveis que têm ação protetora. Quando se empregam inibidores anódicos, deve se ter o cuidado de usar uma quantidade adequada para a proteção, pois para cada inibidor há uma concentração crítica na solução da qual há inibição, mas se a concentração do inibidor apresentar valor mais baixo do que a concentração crítica, o produto insolúvel e protetor não se forma em toda a extensão da superfície a proteger, tendo-se então, corrosão localizada nas áreas não protegidas. Alguns autores chamam os inibidores, que modificam o potencial para um valor mais catódico ou mais nobre, de passivadores. Os exemplos estão nos inibidores anódicos: cromatos, nitritos, molibdatos. Inibidores catódicos: Atuam reprimindo reações catódicas. São substâncias que fornecem íons metálicos capazes de reagir com a alcalinidade catódica, produzindo compostos insolúveis. Esses compostos insolúveis envolvem a área catódica, impedindo a difusão do oxigênio e a condução de elétrons, inibindo assim o processo catódico. Essa inibição provoca acentuada polarização catódica. Sulfatos de zinco, de magnésio e de níquel são usados como inibidores catódicos, pois os íons Zn2+, Mg+ e Ni2+, formam com as hidroxilas, OH-, na área catódica, os 40 respectivos hidróxidos insolúveis: Zn(OH)2, Mg(OH)2 e Ni(OH)2, cessando o processo corrosivo. Os inibidores catódicos agem, portanto, fazendo uma polarização catódica, e como o metal, no catodo, não entre em solução mesmo que esse não esteja totalmente coberto, não haverá corrosão localizada acentuada nessas áreas. Logo, esses inibidores quaisquer que sejam as suas concentrações são considerados mais seguros, o que não ocorre com os anódicos, como visto anteriormente. Inibidores de adsorção: Funcionam como películas protetoras. Algumas substâncias têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica. Nesse grupo estão incluídas substâncias com grupos fortemente polares que dão lugar à formação de películas de adsorção. Entre elas estão os colóides, sabões de metais pesados e substâncias orgânicas com átomos de oxigênio, nitrogênio ou enxofre, podendo-se citar aldeídos, aminas, compostos heterocíclicos nitrogenados, mercaptans, uréia e tiouréias substituídas. As películas de proteção ocasionadas pelos inibidores de adsorção são afetadas por diversos fatores: velocidade do fluido, volume e concentração do inibidor usado para tratamento, temperatura do sistema, tipo de substrato eficaz para adsorção do inibidor, tempo de contato entre o inibidor e a superfície metálica e a composição do fluido do sistema. Em certos casos o oxigênio funciona também como inibidor de adsorção, produzindo a passivação. Algumas substâncias só têm ação inibidora em presença de oxigênio, talvez criando condições mais favoráveis para sua adsorção. Entre essas substâncias estão: hidróxido de sódio, fosfato de sódio, silicato de sódio e tetraborato de sódio. 3.8.1 Nitrito de sódio e benzoato de sódio O nitrito de sódio é um sal que funciona como inibidor anódico, geralmente possui alta eficiência e baixo custo, mas os produtos da reação de compostos do concreto com o nitrito são tóxicos (TRITTHART, 2005, ZHANG e LI, 2003). Lima (2000) investigou o efeito do nitrito de sódio, molibdato de sódio e benzoato de sódio como inibidores de corrosão em corpos-de-prova compostos por concreto e argamassa de reparo durante um período de três meses. A menor taxa de corrosão, segundo lima, foi obtida para corpos-de-prova de argamassa com 1% (em massa) de nitrito de sódio, e o traço que provocou a redução da taxa de corrosão, tanto para argamassa quanto para o concreto, foi o que continha 6% de benzoato de sódio. 41 Ngala e colaboradores (2002) estudaram o efeito do nitrito de cálcio como inibidor de corrosão e concluíram que este não foi eficiente nas condições estudadas, provavelmente devido ao pouco cobrimento da armadura e baixa qualidade do concreto utilizado, além da alta agressividade a que este foi exposto. Mammoliti et al (1999) também observaram ineficiência deste tipo de inibidor com o aumento da concentração de cloreto na água de poro. Apesar das controvérsias observadas na literatura com relação aos sais de nitrito como inibidores de corrosão, estes são usados em quantidades significativas como aditivo na mistura do concreto, no mundo todo, para proteção da armadura contra a corrosão causada por cloretos (TRITTHART AND BANFILL, 2001; SARASWATHY, 2005; MENNUCI, 2006). Por ser um inibidor anódico, se não for adicionado em quantidade suficiente, pode se tornar um inibidor perigoso. Em países da Europa e nos Estados Unidos, novos compostos inibidores de corrosão estão sendo desenvolvidos para substituição daqueles considerados nocivos ao meio ambiente, os quais estão sendo banidos, entre estes, os cromatos e o óxido de chumbo. A atuação destes novos inibidores não prejudiciais ao meio ambiente, em estruturas de concreto armado, precisa ser investigada. O benzoato de sódio tem sido utilizado como inibidor de corrosão para alumínio, cobre, aço e zinco. Atuando somente em presença de oxigênio, é um inibidor anódico, que requer concentrações altas para a passivação efetiva, geralmente usado em teores de 6% a 8% (massa) no concreto. (LIMA, 1996; MENNUCI, 2006) 42 4. MATERIAIS E MÉTODOS 4.1 Matéria prima A matéria prima utilizada neste estudo foi o aço carbono CA 50. Este tipo de aço é obtido através da transformação de sucatas de aços. O aço empregado neste trabalho foi produzido pela empresa Belgo Mineira, e doada pela empresa Rossi Residencial S/A. As barras de aço CA 50, utilizadas foram recebidas na forma cilíndrica e com nervuras, apresentando diâmetro de 16 mm e comprimento de 200 mm, como ilustra a Figura 19. A Tabela 3 apresenta a composição química nominal da liga estudada. A análise química foi fornecida pela empresa que produziu o material. Figura 19. Barra do aço carbono CA 50 ilustrando a matéria prima utilizada para o estudo. Tabela 3. Composição química nominal do aço carbono CA 50 (% de peso). C Si Mn P S Cr Ni Mo Sn Cu Nb 0,30 0,18 0,62 0,030 0,022 0,08 0,07 0,01 0,03 0,22 0,004 V Al Ti Co Pb B N Zn Fe Ceq 0,002 0,447 0,002 0,00 0,00 0,0002 3,0 0,00 0,00 0,44 43 4.2 Caracterização microestrutural As amostras do aço carbono CA 50 foram usinadas em um torno mecânico da Marca Romi e modelo universal (1,5 m), na forma cilíndrica com diâmetro de 10 mm, posteriormente foram cortadas em espessuras de 5 mm em uma cortadeira do tipo “cut-off” da marca Arotec e modelo COR-40. A preparação das amostras para metalografia ótica, foi preparada de acordo com a norma American Society for Testing and Materials (ASTM) E3-95. Inicialmente as amostras foram embutidas em baquelite, numa embutidora da marca Arotec e modelo PRE30Mi, e lixadas em uma politriz da marca Metalprisma e modelo PL02E com lixa de granulometria pré-determinada, variando de 180 a 1200 mesch. Posteriormente as amostras foram polidas com alumina 0,2 µm e 0,4 µm, sendo levadas então, para um banho ultrasônico em um ultra-som da marca Odontobrás e modelo 1440D, durante 20 minutos, imersas em álcool, com posterior secagem em jato quente de ar. A Figura 20 mostra a seqüência de preparação das amostras para a caracterização microestrutural. A microestrutura foi revelada por imersão em Nital 3% (3% de ácido nítrico em álcool etílico), a temperatura ambiente. Posteriormente as amostras foram caracterizadas por microscopia ótica, nas direções longitudinal e transversal, para avaliar a morfologia da microestrutura nas duas direções, utilizado um microscópio ótico da marca Olympus, modelo BH2-UMA, acoplado à câmera de vídeo e placa digitalizadora acoplada a um computador, para analisar a morfologia da microestrutura do aço carbono CA 50. 44 Direção de execução. Figura 20. Seqüência ilustrativa da preparação dos corpos de prova para a caracterização microestrutural. 4.3 Ensaios de corrosão 4.3.1 Preparação dos meios A Tabela 4 fornece a composição da solução da água de poro do concreto (0,01N de NaOH + 0,05N de KOH) em g/l de água destilada. A introdução do cloreto de sódio (NaCl) na água de poro do concreto tem a finalidade de aumentar a agressividade do meio, e a esta solução foram adicionados separadamente os inibidores nitrito de sódio e benzoato de sódio em diferentes concentrações. Os meios utilizados nos ensaios de imersão e eletroquímicos estão apresentados na Tabela 5. Tabela 4. Componentes da solução da água de poro do concreto em g/l de água destilada. (Barneyback e Diamond apud Miranda et al, 1990) Solução 1 (água de poro do concreto) (g/l) NaOH KOH 0,4 2,8 45 Tabela 5. Meios empregados nos ensaios de imersão e eletroquímicos de corrosão. Solução 1 Água de poro do concreto (0,01N de NaOH + 0,05N de KOH) Solução 2 Água de poro do concreto + 3,5% de NaCl (Referência) Solução 3 Água de poro do concreto + 3,5% de NaCl + 0,5% de nitrito de sódio Solução 4 Água de poro do concreto + 3,5% de NaCl + 1,0% de nitrito de sódio Solução 5 Água de poro do concreto + 3,5% de NaCl + 2,0% de nitrito de sódio Solução 6 Água de poro do concreto + 3,5% de NaCl + 1,0% de benzoato de sódio Solução 7 Água de poro do concreto + 3,5% de NaCl + 2,0% de benzoato de sódio 4.3.2 Ensaios de imersão 4.3.2.1 Preparação dos corpos de prova Os corpos de prova para ensaio de imersão foram preparados a partir do aço carbono CA 50 na forma de barra cilíndrica, com diâmetro de 10 mm e espessura 10 mm. Posteriormente as amostras foram lixadas em uma politriz com lixa de granulometria prédeterminada, variando de 180 a 1200 mesch. Em seguida, as amostras foram levadas para um banho ultra-sônico, durante 10 minutos, imersas em álcool, com posterior secagem em jato quente de ar. A Figura 21 mostra a seqüência de preparação dos corpos de prova para os ensaios de imersão. 46 Direção de execução. Figura 21. Seqüência ilustrativa da preparação dos corpos de prova para os ensaios de imersão. 4.3.2.2 Equipamentos e acessórios Para a realização dos ensaios de imersão foram utilizados béquers com capacidade de 200 ml e as soluções mostradas na Tabela 5. A pesagem das amostras foi realizada numa balança analítica de precisão de 0,0001 mg, da marca Tecnal e modelo Classe 1. A avaliação da superfície das amostras do aço carbono CA 50, antes e depois dos ensaios de imersão, foram realizadas visualmente e com o auxílio de um microscópio ótico da marca Olympus, modelo BH2-UMA, acoplado à câmera de vídeo e placa digitalizadora acoplada a um computador. 4.3.2.3 Técnica do ensaio O ensaio de imersão foi realizado segundo a norma ASTM G31-72 e consistiu na imersão de amostras do aço carbono CA 50, nas soluções conforme mostra a Tabela 5. As amostras antes dos ensaios foram pesadas e fotografadas por microscopia ótica e posteriormente colocadas em imersão, onde permaneceram por um período de 61 dias. Finalizado o período de imersão, as amostras foram retiradas das soluções e fotografadas por microscopia ótica, e posteriormente pesadas novamente com e sem o produto de corrosão sobre as superfícies. 47 Com isso foi possível determinar a taxa de corrosão, calculada segundo a norma ASTM G31-72 a partir das Equações (2) e (3). Taxa de corrosão = (K x W) / (A x T x D) (2) Onde: K = constante (3,45x106), para que a taxa de corrosão seja na unidade mpy; W = perda de massa em gramas; A = área do corpo de prova em cm2 dada pela Equação (3); T = tempo em horas em imersão; D = densidade do aço em g/cm3 (7,86 g/cm3 para o aço carbono CA 50, VAN VLACK, 1977). A = π/2(d2) + tπd (3) Onde: π = constante; d = diâmetro da amostra em cm; t = espessura da amostra em cm. 4.3.3 Ensaios eletroquímicos de corrosão 4.3.3.1 Preparação dos corpos de prova Os corpos de prova para os ensaios eletroquímicos foram preparados de acordo com a norma ASTM G5-94, a partir do aço carbono CA 50 na forma de barra laminada, o aço foi usinado na forma cilíndrica com diâmetro de 10 mm e espessura de 5 mm. Nas amostras foram soldados fios de cobre para o contado elétrico e em seguida, as amostras foram embutidas em resina poliéster de cura a frio e lixados em uma politriz com lixa SiC com granulações de 150 até 1200 mesch. A Figura 22 mostra a seqüência de preparação dos corpos de prova para os ensaios de corrosão. 48 Direção de execução. Figura 22. Seqüência ilustrativa da preparação dos corpos de prova para os ensaios eletroquímicos de corrosão. 4.3.3.2 Equipamentos e acessórios Os ensaios eletroquímicos foram realizados a partir da técnica de polarização potenciodinâmica, segundo as normas ASTM G5-94 e ASTM G61, com o objetivo de obter os parâmetros eletroquímicos do aço carbono CA 50. O equipamento utilizado foi um potenciostato da marca Microquímica, com uma interface eletroquímica, modelo MQPG-01, conectado a uma célula eletroquímica, ilustrados pela Figura 23. A interface eletroquímica modelo MQl12/8, acoplada ao microcomputador dispõe de um Programa de Aquisição e Controle – PAC que permite realizar os ensaios eletroquímicos que são controlados pelo computador. A interface eletroquímica aplica o sinal de potencial à entrada do potenciostato e lê o sinal de corrente. A célula eletroquímica, ilustrada pela Figura 24, é composta de três eletrodos, entrada de gás e termômetro para controle de temperatura. Foi utilizado o eletrodo de calomelano saturado (ECS) como de referência, um contra eletrodo (ou auxiliar) de platina e o eletrodo de trabalho (aço carbono CA 50). 49 Figura 23. Equipamentos utilizados para realização dos ensaios eletroquímicos. Figura 24. Célula eletroquímica utilizada para os ensaios eletroquímicos. 4.3.3.3 Curvas de polarização potenciodinâmica Uma curva típica é vista na Figura 25. Trata-se de uma polarização anódica (a partir do Ecorr para valores mais positivos) do aço. Cascudo (1997) explica que a região “A” na figura é a região ativa, na qual a amostra corrói quando o potencial aplicado torna-se mais positivo. Caminhando-se para “B” inicia-se a passivação; este ponto é caracterizado por dois valores de coordenadas: o potencial passivo primário (Epp) e a densidade de corrente 50 elétrica (ic). Na região “C” a corrente decresce rapidamente à medida que o filme passivante se forma sobre a amostra. A região “D” é a região de passivação, onde existe pouca mudança de corrente com o aumento de potencial. Finalmente, tem-se a região “E” que é a região transpassiva, caracterizada pelo desprendimento de O2. Figura 25. Curva de polarização anódica potenciodinâmica padrão do aço inoxidável. (CASCUDO, 1997) Informações quantitativas do processo de corrosão podem ser obtidas com o método de extrapolação de Tafel (“método de inserção”), através das conhecidas curvas de Tafel, como ilustra a Figura 26. Este método consiste em polarizações potenciodinâmicas no sentido anódico e catódico, as quais geram correspondentes ramos anódicos e catódicos, numa curva de polarização de sobretensão versus logaritmo da densidade de corrente. A extrapolação dos referidos ramos, que culmina com sua interseção, gera um par de valores coordenados, os quais são: o potencial de corrosão (Ecorr) e a densidade de corrente de corrosão (icorr) do sistema. 51 Figura 26. Curvas de polarização potenciodinâmica e extrapolação das retas de Tafel para determinação do potencial de corrosão (Ecorr) e da densidade de corrente de corrosão (icorr). (SOUZA apud MENNUCI, 2006) 52 5. RESULTADOS E DISCUSSÕES 5.1 Caracterização microestrutural A avaliação microestrutural do aço foi realizada nas secções transversal e longitudinal do aço. A observação da superfície foi realizada após lixamento, polimento com alumina em suspensão e ataque com Nital 3%. As Figuras 27a - 27f mostram a microestrutura da secção longitudinal e transversal do aço e observa-se que não houve variação significativa na microestrutura obtida. Apresenta uma morfologia heterogênea em termos de tamanho e distribuição dos grãos, com grãos ferríticos (região clara) e grãos perlíticos (região escura - perlita é microconstituinte lamelar formado pelas fases ferrita e cementita) distribuídos na matriz. A microestrutura obtida é a esperada para um aço com teor de carbono em torno de 0,3%C, conforme a literatura (ASM HANDBOOK, 1985). Grãos perlíticos Grãos ferríticos Grãos perlíticos Grãos ferríticos (a) (b) Grãos perlíticos Grãos ferríticos Grãos perlíticos Grãos ferríticos (c) (d) 53 Cementita: Regiões escuras Ferrita: Regiões claras Cementita: Regiões escuras Ferrita: Regiões claras (e) (f) Figura 27. Micrografias do aço carbono CA50. a) Seção longitudinal com ampliação de 200x; b) Seção transversal com ampliação de 200x; c) Seção longitudinal com ampliação de 500x; d) Seção transversal com ampliação de 500x; e) Seção longitudinal com ampliação de 800x; f) Seção transversal com ampliação de 800x. 5.2 Ensaios de imersão Após os períodos de imersão as amostras do aço carbono CA 50, foram retiradas das soluções de ensaio e apresentaram-se conforme mostra a Figura 28. As amostras de 1 a 7 referem-se respectivamente à imersão em Solução 1 (água de poro), Solução 2 (referência), Solução 3 (0,5% nitrito), Solução 4 (1,0% nitrito), Solução 5 (2,0% nitrito), Solução 6 (1,0% benzoato) e Solução 7 (2,0% benzoato), conforme a Tabela 5. Pode-se notar que as amostras 1 e 2, apresentaram produto de corrosão bastante intenso sobre suas superfícies. Já as amostras 3 e 4 apresentaram pequena quantidade de produto de corrosão, a amostra 5 apresentou uma superfície completamente limpa, mostrando que o nitrito de sódio nas concentrações estudadas diminuiu a formação do produto de corrosão. No entanto, as amostras 6 e 7, apresentaram grande quantidade de produto de corrosão sobre suas superfícies, onde conclui-se que o benzoato nas concentrações estudadas não inibiu a formação do produto de corrosão. 54 (a) (b) (c) (d) (e) (f) (g) Figura 28. Fotos das amostras do aço carbono CA 50 após ensaios de imersão. a) Amostra 1; b) Amostra 2; c) Amostra 3; d) Amostra 4; e) Amostra 5; f) Amostra 6; g) Amostra 7. As superfícies das amostras após os períodos de imersão nas soluções de estudo, foram analisadas por microscopia ótica e as micrografias são mostradas nas Figuras 29 a 35. A superfície das amostras 1 e 2 imersas respectivamente em solução de água de poro (Solução 1) e na solução de Referência (Solução 2) apresentaram-se de forma semelhantes, com duas regiões distintas: corrosão por pites, conforme mostram as Figuras 29b e 30b, e a outra corrosão generalizada, com produto de corrosão compacto aderente e homogêneo, conforme mostram as Figuras 29c e 30c. Posteriormente, o produto de corrosão foi removido pelo lixamento das superfícies das amostras e constatou-se a presença de pites sob a corrosão generalizada, conforme ilustram as Figuras 29d e 30d. 55 Corrosão Corrosão Generalizada Generalizada Pites Corrosão por Pites (a) (b) Corrosão Generalizada Corrosão por Pites (c) (d) Figura 29. Micrografias da amostra 1 após ensaio de imersão em água de poro. a) Ampliação de 50x; b) Ampliação de 200x; c) Ampliação de 500x; d) Ampliação de 200x. 56 Corrosão Generalizada Pites Corrosão por Pites (a) (b) Corrosão Generalizada Corrosão por Pites (c) (d) Figura 30. Micrografias da amostra 2 (Referência) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 200x; c) Ampliação de 200x; d) Ampliação de 200x. No entanto, as amostras 3, 4 e 5 imersas respectivamente nas soluções de 0,5%, 1,0% e 2,0% de nitrito de sódio, não apresentaram a corrosão generalizada, apenas corrosão por pite, como mostram as Figuras 31, 32 e 33. Observa-se que a quantidade de pites nucleados foi menos intensa do que nas amostras 1 e 2, demonstrando que o nitrito de sódio nas concentrações estudadas inibiu a formação do produto de corrosão e diminuiu a formação dos pites na superfície. As amostras 6 e 7 imersas respectivamente nas soluções de 1,0% e 2,0% de benzoato de sódio, apresentaram início de corrosão generalizada, observada pela superfície das amostras mais escurecidas e corrosão por pite bastante intensa, como ilustram as Figuras 34 e 35, mostrando que o benzoato de sódio nas concentrações estudadas não inibiu a formação do produto de corrosão e a corrosão por pites. 57 Corrosão por Pites Pites (a) (b) Figura 31. Micrografias da amostra 3 (0,5% nitrito de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 200x. Corrosão por Pites Pites (a) (b) Figura 32. Micrografias da amostra 4 (1,0% nitrito de sódio) após ensaio de imersão. a) Ampliação de 100x; b) Ampliação de 500x. Corrosão por Pites Pite (a) (b) Figura 33. Micrografias da amostra 5 (2,0% nitrito de sódio) após ensaio de imersão. a) Ampliação de 100x; b) Ampliação de 500x. 58 Corrosão Generalizada (início) + Pites Pite (a) (b) Figura 34. Micrografias da amostra 6 (1,0% benzoato de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 500x. Corrosão Generalizada (início) + Pites (a) Pite (b) Figura 35. Micrografias da amostra 7 (2,0% benzoato de sódio) após ensaio de imersão. a) Ampliação de 50x; b) Ampliação de 500x. A Tabela 6 mostra os resultados dos ensaios de imersão para cada amostra em suas respectivas soluções de ensaio, com os valores das perdas de massa e das taxas de corrosão. A amostra 1 apresentou valor da perda de massa de 0,20% e da taxa de corrosão de 0,75 mpy. Com a adição de 3,5% de NaCl os valores da perda de massa e da taxa de corrosão da amostra 2 aumentaram significantemente para respectivamente 0,63% e 2,38 mpy, comprovando que a adição de NaCl é bastante agressiva para o material conforme observado nos ensaios eletroquímicos. Nas soluções com nitrito de sódio os valores das perdas de massa e das taxas de corrosão diminuíram em comparação com a solução de referência, sendo que para a amostra 3 esses valores são de 0,03% e 0,31 mpy respectivamente, para a amostra 4 são de 0,13% e 0,47 mpy e para a amostra 5 de 0,03% e 0,11 mpy, mostrando que a adição de 2,0% nitrito de sódio foi a mais eficiente, em contradição com os ensaios eletroquímicos que 59 mostram que a solução de 1,0% é a mais eficiente. Isso pode ter sido causada pela diferença nas condições de ensaios. Nos ensaios de polarização as medidas tiveram início em potenciais catódicos (em torno de -0,2V) em relação ao potencial de corrosão. A polarização catódica pode ter favorecido a atuação do nitrito de sódio na concentração de 1% em massa. No entanto, as amostras 6 e 7, imersas em soluções de benzoato de sódio apresentaram respectivamente valores de perdas de massa e de taxas de corrosão de 0,51% e 1,94 mpy e de 0,45% e 1,73 mpy, mostrando que houve pequena variação desses valores para as concentrações de 1% e 2% de benzoato de sódio. Este ensaio demonstrou que o inibidor nitrito de sódio nas mesmas concentrações que o inibidor benzoato de sódio foi mais eficiente, pois apresentou menor taxa de corrosão. 60 Tabela 6. Valores das perdas de massa e das taxas de corrosão das amostras do aço carbono CA 50 para cada solução dos ensaios de imersão. Solução do ensaio Solução 1 (água de poro) Solução 2 (Referência) Am. Perda Perda Peso 1 Peso 2 Peso 3 de de (g) (g) (g) Massa Massa (g) (%) Taxa de Corrosão (mpy) 1 5,7099 5,7263 5,6987 0,0112 0,20 0,75 2 5,3414 5,3563 5,3077 0,0337 0,63 2,38 3 5,6641 5,6672 5,6595 0,0046 0,08 0,31 4 5,2586 5,2648 5,2520 0,0066 0,13 0,47 5 5,6431 5,6433 5,6415 0,0016 0,03 0,11 6 5,7003 5,7143 5,6713 0,0290 0,51 1,94 7 5,7335 5,7930 5,7076 0,0259 0,45 1,73 Solução 3 (0,5% Nitrito de sódio) Solução 4 (1,0% Nitrito de sódio) Solução 5 (2,0% Nitrito de sódio) Solução 6 (1,0% Benzoato de sódio) Solução 7 (2,0% Benzoato de sódio) Am. Corresponde a numeração das amostras; Peso 1. Corresponde ao peso das amostras antes dos ensaios de imersão; Peso 2. Corresponde ao peso das amostras após os ensaios de imersão com o produto de corrosão; Peso 3. Corresponde ao peso das amostras após os ensaios de imersão sem o produto de corrosão. 61 5.3 Ensaios eletroquímicos de corrosão A Figura 36 mostra as curvas de polarização potenciodinâmica para o aço carbono CA 50 em solução que simula água de poro (Solução 1), após 4 dias em imersão e em solução que simula água de poro com adição de 3,5% de NaCl (Solução 2). Através da curva da água de poro é possível observar que o aço encontra-se passivado neste meio, e permanece assim até o potencial de aproximadamente 741 mV, onde a partir deste ocorre a quebra da película passiva que protege o aço contra a corrosão. Porém, a curva de polarização do aço CA 50 em solução de água de poro com adição de 3,5% de NaCl, mostra que a adição do cloreto de sódio causou um aumento no valor da densidade de corrente de corrosão (icorr) e a diminuição do potencial de corrosão (Ecorr). O Ecorr observado na solução de água de poro foi de aproximadamente -144 mV, enquanto que na solução de água de poro com adição de NaCl foi em torno de -663 mV, mostrando que os íons de cloro provocam uma diminuição da resistência à corrosão do aço CA 50 quando presentes. Dessa forma, a curva da água de poro com adição de 3,5% de NaCl foi tomada como referência para as comparações com as curvas com adição dos inibidores de corrosão por apresentar maior agressividade ao material. 1500 Potencial, E, (mV) 1000 500 0 -500 -1000 -1500 -2000 Solução 1: água de poro (4 dias em imersão) Solução 2 (Referência): água de poro + 3,5% de NaCl -2500 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 36. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro (Solução 1) após 4 dias de imersão e em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência). 62 As Figuras 37, 38 e 39 mostram as curvas de polarização potenciodinâmica para o aço carbono CA 50, respectivamente em água de poro com adição de 3,5% de NaCl e 0,5% de nitrito de sódio (Solução 3), em água de poro com adição de 3,5% de NaCl e 1,0% de nitrito de sódio (Solução 4) e em água de poro com adição de 3,5% de NaCl e 2,0% de nitrito de sódio (Solução 5), todas em comparação com a curva de referência (Solução 2). Podemos notar através das curvas de polarização que o nitrito de sódio nas concentrações de ensaio teve efeito inibidor da corrosão no aço, pois se observa que os valores dos potenciais de corrosão (Ecorr) deslocam-se para valores maiores e que os valores das densidades de corrente de corrosão (icorr) deslocam-se para valores menores. A curva com concentração de 0,5% de nitrito mostra que o valor do potencial de corrosão (Ecorr) e da densidade de corrente de corrosão (icorr) são respectivamente da ordem de -460 mV e 2,5X10-5 A/cm². O aumento da concentração de 0,5% de nitrito para 1,0% causou um aumento do potencial de corrosão (Ecorr) e uma diminuição da densidade de corrente de corrosão (icorr), com valores respectivamente de -378 mV e 1,1X10-5 A/cm². No entanto, no aumento da concentração de 1,0% de nitrito para 2,0%, o potencial de corrosão (Ecorr), permaneceu em valor muito próximo ao valor com 1,0% de nitrito, sendo esse da ordem de -370 mV, porém o da densidade de corrente de corrosão (icorr) teve um grande aumento, passando a ser aproximadamente de 6,5X10-5 A/cm², mostrando que a concentração de 1,0% de nitrito tem efeito inibidor da corrosão mais eficiente do que com 2,0%. 63 1000 Potencial, E, (mV) 500 0 -500 -1000 -1500 -2000 Solução 2 (Referência): água de poro + 3,5% de NaCl Solução 3: água de poro + 3,5% de NaCl + 0,5% de nitrito de sódio -2500 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 37. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 0,5% de nitrito de sódio (Solução 3). 1000 Potencial, E, (mV) 500 0 -500 -1000 -1500 -2000 Solução 2 (Referência): água de poro + 3,5% de NaCl Solução 4: água de poro + 3,5% de NaCl + 1% de nitrito de sódio -2500 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 38. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 1,0% de nitrito de sódio (Solução 4). 64 1000 Potencial, E, (mV) 500 0 -500 -1000 -1500 -2000 Solução 2 (Referência): água de poro + 3,5% de NaCl Solução 5: água de poro + 3,5% de NaCl + 2,0% de nitrito de sódio -2500 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 39. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 2,0% de nitrito de sódio (Solução 5). As Figuras 40 e 41 mostram as curvas de polarização potenciodinâmica para o aço, respectivamente em solução que simula água de poro com adição de 3,5% de NaCl e 1,0% de benzoato de sódio (Solução 6), em água de poro com adição de 3,5% de NaCl e 2,0% de benzoato de sódio (Solução 7), ambas em comparação com a curva de referência (Solução 2). A utilização de 1,0% de benzoato de sódio mostra que o valor do potencial de corrosão (Ecorr) é da ordem de -571 mV e da densidade de corrente de corrosão (icorr) da ordem de 4,8X10-5. O aumento da concentração para 2,0% causou uma pequena diminuição no potencial de corrosão (Ecorr), passando a ser de aproximadamente -587 mV e a diminuição expressiva da densidade de corrente de corrosão (icorr), para aproximadamente 1,6X10-5 A/cm². A Figura 42 ilustra as curvas de polarização do aço carbono CA 50, em solução de água de poro e em todas as concentrações de inibidores estudados em comparação com a curva de referência. 65 1000 Potencial, E, (mV) 500 0 -500 -1000 -1500 -2000 Solução 2 (Referência): água de poro + 3,5% de NaCl Solução 6: água de poro + 3,5% de NaCl + 1% de benzoato de sódio -2500 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 40. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 1,0% de benzoato de sódio (Solução 6). 1000 Potencial, E, (mV) 500 0 -500 -1000 -1500 -2000 Solução 2 (Referência): água de poro + 3,5% de NaCl Solução 7: água de poro + 3,5% de NaCl + 2% de benzoato de sódio -2500 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 41. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em água de poro com adição de 3,5% de NaCl (Solução 2 – Referência) e em água de poro com adição de 3,5% de NaCl e 2,0% de benzoato de sódio (Solução 7). 66 1500 Solução 1: água de poro (4 dias em imersão) Solução 2 (Referência): água de poro + 3,5% de NaCl Potencial, E, (mV) 1000 500 0 -500 -1000 -1500 -2000 -2500 Solução 3: água de poro + 3,5% de NaCl + 0,5% de nitrito de sódio Solução 4: água de poro + 3,5% de NaCl + 1% de nitrito de sódio Solução 5: água de poro + 3,5% de NaCl + 2% de nitrito de sódio Solução 6: água de poro + 3,5% de NaCl + 1% de benzoato de sódio Solução 7: água de poro + 3,5% de NaCl + 2% de benzoato de sódio 1E-7 1E-6 1E-5 1E-4 1E-3 0,01 0,1 1 2 Densidade de corrente, i, (A/cm ) Figura 42. Curvas de polarização potenciodinâmica para o aço carbono CA 50 em soluções conforme indicado na Tabela 5. A Tabela 7 mostra os valores dos potenciais de corrosão (Ecorr) e corrente de corrosão (icorr) obtidos a partir das curvas de polarização potenciodinâmica e os valores de eficiência dos inibidores, utilizando os valores de icorr, calculados a partir da Equação (4), obtida pela Equação (1) (Gentil, 1982): Ef = (is/inib. - ic/inib.) / is/inib. x 100 (4) Onde: Ef = eficiência em porcentagem; is/inib. = densidade de corrente de corrosão sem inibidor; ic/inib. = densidade de corrente de corrosão com inibidor. A eficiência de inibição da corrosão devido ao nitrito de sódio na concentração de 1,0% em massa foi de 98%, próxima daquelas correspondentes a 0,5% em massa de nitrito de sódio (eficiência de 95%) e 2% em massa de benzoato de sódio (eficiência de 97%). E também foi observado que a concentração de 1,0% em massa de nitrito de sódio apresentou eficiência superior das obtidas nas concentrações de 2,0% em massa do mesmo inibidor, assim como na concentração de 1% do benzoato de sódio. 67 Esses resultados demonstram que é possível empregar nesse aço o nitrito de sódio na concentração de 0,5% em massa, ao invés de 1% em massa que é a concentração empregada na prática em obras que usam inibidores como método de proteção contra a corrosão. Tabela 7. Valores dos potenciais de corrosão (Ecorr) e densidades de corrente de corrosão (icorr) obtidos a partir das curvas de polarização potenciodinâmica e valores das eficiências dos inibidores. Solução do ensaio Ecorr (mV) icorr (A/cm²) Eficiência (%) -144 1,1X10-7 --- -663 50X10-5 --- -460 2,5X10-5 95 -378 1,1X10-5 98 -370 6,5X10-5 87 -571 4,8X10-5 90 -587 1,6X10-5 97 Solução 1 (água de poro) Solução 2 (Referência) Solução 3 (0,5% Nitrito de sódio) Solução 4 (1,0% Nitrito de sódio) Solução 5 (2,0% Nitrito de sódio) Solução 6 (1,0% Benzoato de sódio) Solução 7 (2,0% Benzoato de sódio) 68 6. CONCLUSÕES A microestrutura do aço carbono CA 50 estudado apresenta uma morfologia heterogênea em termos de tamanho e distribuição dos grãos e é constituída de uma matriz ferrítica com grãos perlíticos distribuídos na matriz. A presença de íons de cloro na água de poro do concreto provoca a diminuição da resistência à corrosão do aço carbono CA 50, apresentando grande agressividade ao material. A eficiência de inibição da corrosão devido ao nitrito de sódio na concentração de 1,0% em massa foi de 98%, próxima daquelas correspondentes a 0,5% em massa de nitrito de sódio (eficiência de 95%) e 2% em massa de benzoato de sódio (eficiência de 97%). A concentração de 1,0% em massa de nitrito de sódio apresentou eficiência superior das obtidas nas concentrações de 2,0% em massa do mesmo inibidor, assim como na concentração de 1% do benzoato de sódio. Esses resultados demonstram que é possível empregar nesse aço o nitrito de sódio na concentração de 0,5% em massa, ao invés de 1%, que é a concentração empregada em obras que usam inibidores contra a corrosão. Os ensaios de imersão demonstraram que os inibidores utilizados reduziram a taxa de corrosão em comparação com a solução de referência (sem inibidor). E o inibidor nitrito de sódio apresentou menor taxa de corrosão em comparação ao benzoato de sódio, nas mesmas concentrações usadas. 69 REFERÊNCIAS BIBLIOGRÁFICAS AMERICAN SOCIETY FOR TESTING AND MATERIALS. Standard method for conducting cyclic potentiodynamic polarization measurements for localized corrosion susceptibility of iron. Designation G61. In: Annual Book of ASTM Standards. Philadelphia. vol. 03.02, 1991. AMERICAN SOCIETY FOR TESTING AND MATERIALS. Standard methods of preparation of metallographic specimens. Designation E3 - 95 (Reapproved 1995). In: Annual Book of ASTM Standards: metals -mechanical testing; elevated and low-temperature tests, metallography. Philadelphia. vol. 03.01, 1995. AMERICAN SOCIETY FOR TESTING AND MATERIALS. Standard practice for laboratory immersion corrosion testing of metals. Designation G31 – 72. In: Annual Book of ASTM Standards. Philadelphia. 1999. AMERICAN SOCIETY FOR TESTING AND MATERIALS. Standard reference test method for making potentiostatic and potentiodinamic anodic polarization measurements. Designation G5 – 94. In: Annual Book of ASTM Standards. Philadelphia. vol. 03.02, 1994. ASM HANDBOOK. Metallograpy and Microstructures. 9º ed. United States of America: The Materials Information Society, 1985. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS. NBR 7480. Barras e fios de aço destinados a armaduras para concreto armado. Rio de Janeiro, 1999. ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS. NBR 6118. Projeto de estruturas de concreto – Procedimento. Rio de Janeiro, 2003. ANDRADE, C. Manual para diagnóstico de obras deterioradas por corrosão de armaduras. São Paulo: Pini, 1992. ANDRADE, C. Corrosão de armaduras. São Paulo, escola Politécnica da universidade de São Paulo – Curso de Pós-Graduação em Engenharia de Construção Civil e Urbana, 1992. \Apostila da disciplina PCC-770\. CASCUDO, O. Influência das características do aço carbono destinado ao uso como armaduras para concreto armado no comportamento frente à corrosão. 2000. p.310. Tese (Doutorado) Escola Politécnica, Universidade de São Paulo. São Paulo. CASCUDO, O. O controle da corrosão de armaduras em concreto. São Paulo: Pini, 1997. p. 61-67. 70 CHIAVERINI, V. Aços e Ferros Fundidos. Associação Brasileira de Metais. São Paulo: 1990. CRIVELARO, M. Monitoramento da corrosão das armaduras em estruturas de concreto usando dispositivo feito de material reciclável. 1997. p. 147. Dissertação (Mestrado) – Escola de Engenharia, Universidade Presbiteriana Mackenzie. São Paulo. GENTIL, V. Corrosão. Rio de Janeiro: Guanabara Dois, 1982. p. 295-301. HELENE, P.R.L. Corrosão em armaduras para concreto armado. São Paulo: Pini, 1986. LIMA, R.C. Inibidores de corrosão – Avaliação da eficiência frente à corrosão de armaduras provocadas por cloretos. 1996. p. 174. Tese (Doutorado) – Escola Politécnica, Universidade de São Paulo, São Paulo. LIMA, R.C. Avaliação da eficiência de inibidores de corrosão em reparos de estruturas de concreto. 2000. p. 169. Dissertação (Mestrado) – Escola Politécnica, Universidade de São Paulo, São Paulo. MAMEDE, F.C. Seminário de fundamentos do concreto 1; propriedades dos aços. Seminário – Escola de Engenharia de São Carlos, Departamento de Engenharia de Estruturas, Universidade de São Paulo. São Carlos. 1999. p. 12. MAMMOLITI, L.; HANSSON, C.M.; HOPE, B.B. Corrosion inhibitors in concrete Part II: Effect on chloride threshold values for corrosion of steel in synthetic pore solutions. Cement and Concrete Research. 29, 1999. p. 1583-1589. MENUCCI M.M. Avaliação da potencialidade de aditivos como inibidores de corrosão do aço carbono CA50 usado como armadura de estruturas de concreto. 2006. Dissertação (Mestrado) – Instituto de Pesquisas Energéticas e Nucleares, Universidade de São Paulo, São Paulo. MIRANDA, T.R.V. et al. Utilização do nitrito de sódio como inibidor do processo corrosivo em armaduras. In: SEMINÁRIO DE CORROSÃO NA CONSTRUÇÃO CIVIL, 4, Rio de Janeiro, 1990. Anais... Rio de Janeiro: ABRACO, 1990. p. 94-109. NGALA, V.T.; PAGE, C.L.; PAGE, M.M. Corrosion inhibitor systems for remedial treatment of reinforced concrete. Part.1: calcium nitrite. Corrosion Science. 44, 2002. p.2073-2087. OLIVEIRA C.T.A. Água de poro de pastas de cimento de escória. 2000. p. 9-10. Tese (Doutorado) - Universidade de São Paulo, Escola Politécnica, São Paulo. 71 POURBAIX, M. Atlas of electrochemical equilibrium in aqueous solutions. Houston: Nace, 1974. RAMANATHAN, L.V. Corrosão e seu Controle. São Paulo: Hemus, s.d. SARASWATHY, V.; SONG, H. Improving the durability of concrete by using inhibitors. Building and Environment. Artigo impresso. 6/10/2005. SHAFFER Jr., Thomas F. 1971. Aço galvanizado para estruturas de concreto armado. In: Simpósio sul-americano de corrosão metálica, 2, Rio de Janeiro, 1971. Anais... Rio de Janeiro: Associação Brasileira de Corrosão, Instituto Brasileiro de Petróleo, 1971. TRITTHART, J.; BANFILL, P.F.G. Nitrite binding in cement. Cement and Concrete Research. 31, 2001. p. 1093-1100. TRITTHART, J. Transport of a surface-applied corrosion inhibitor in cement paste and concrete. Cement and Concrete Research. 35, 2005. p. 1804-1813. VAN VLACK, L. H. Princípios de ciências dos materiais. 4º ed. São Paulo: Edgard Blücher LTDA, 1977. ZHANG, T.; LI, D.Y. The effect of YCl3 and LaCl3 additives on wear of 1045 and 304 steels in a dilute chloride solution. Materials science & engineering. A345, 2003. p. 179189.
Download