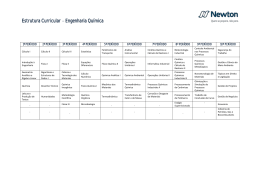
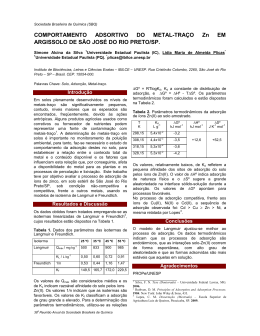
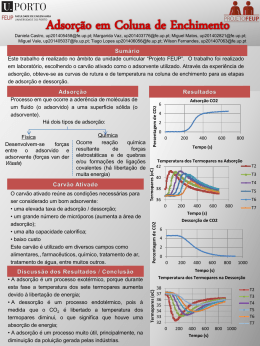
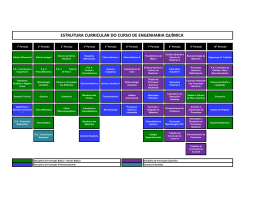
UNIVERSIDADE FEDERAL FLUMINENSE INSTITUTO DE QUÍMICA D ISCIPLINA : GFQ00019 D EPARTAMENTO DE F ÍSICO -QUÍMICA Conteúdo de Estudos: FÍSICO-QUÍMICA Carga Horária Total: 60 h FÍSICO-QUÍMICA V - Código: 260-7 Teórica: 60 h Prática: - Estágio: - Disciplina: Obrigatória. Oferecida para o(s) Curso(s): Bacharelado em Química, Licenciatura em Química, Química Industrial, Engenharia Química e Engenharia de Petróleo. Objetivos da Disciplina: Proporcionar conhecimentos básicos e compreensão da aplicação Termodinâmica aos fenômenos de superfície e eletroquímicos, bem como fornecer as bases para estudo cinético, tanto empírico como teórico das reações químicas, incluindo reações catalíticas. Descrição da Ementa: Fenômenos de Superfície: tensão superficial e fenômenos decorrentes; adsorção física e química. Eletroquímica: teorias das soluções eletrolíticas; Termodinâmica de pilhas; cinética de eletrodos. Cinética Química: Leis empíricas e mecanismos; Teoria das Colisões de velocidade de reações; Teoria do Estado de Transição; catálise. Instrumentos de Acompanhamento e Avaliação: Listas de exercícios, testes, seminários e/ou outras atividades poderão ser realizadas em conjunto com as avaliações escritas no processo de acompanhamento da aprendizagem e da avaliação dos alunos. Conteúdo Programático: 1. Superfícies líquidas: a interface líquido–vapor. Forças originadas na superfície curva de um líquido. A equação de Young–Laplace. Fenômenos capilares. Métodos de medida da tensão superficial. Dependência da tensão superficial com a temperatura. Pressão de vapor sobre a superfície curva de um líquido. Tensão superficial de soluções. A equação de Shishkovsky. Tensão interfacial. Filmes sobre substratos líquidos; 2. Superfícies sólidas: a interface sólido–líquido; 3. Adsorção: conceitos. Histórico. Tipos de adsorção. Calor de adsorção. A isoterma de Freundlich. A equação de Henry. A teoria da adsorção monomolecular de Langmuir. A teoria da adsorção polimolecular. Adsorção química. Adsorção na interface gás–solução. A equação de adsorção de Gibbs. Adsorção na interface sólido–solução; 4. Teoria de eletrólitos: conceitos básicos. A dissociação eletrolítica. A teoria da dissociação eletrolítica de Arrhenius. A interação íon–dipolo. O modelo de Debye–Hückel. A confirmação experimental. O modelo melhorado. Medida de potenciais químicos; 5. Fenômenos de não-equilíbrio em soluções de eletrólitos. A condutância: conceitos básicos. O movimento dos íons. Tratamento teórico da condutividade. Efeito da freqüência e da intensidade do campo elétrico aplicado. Medida de condutividade. Aplicações da condutividade. GFQ00019 Página 1 de 1 Determinação da constante de dissociação. Determinação da carga de um eletrólito. Titulações condutimétricas; 6. Potenciais de eletrodo: origens dos potenciais de eletrodo. A dupla camada elétrica. Equação de Nernst. Pilhas de concentração. Usos de potenciais padrão de eletrodos. Potenciais. Energia de Gibbs e constantes de equilíbrio. Eletrodos de referência e indicadores. Eletrodos íons – seletivos. O eletrodo de vidro. Outros eletrodos de membrana sólida. Baterias e células de combustível; 7. Cinética química: conceitos básicos. Análise de resultados cinéticos. O método diferencial. O método de integração. O método de isolamento. Tempo de meia-vida. Comparação dos métodos. Reações opostas. A influência da temperatura na velocidade das reações. Energia de ativação. Distribuição estatística de energias moleculares. Superfícies de energia potencial; 8. Teorias sobre as velocidades de reação: Teoria das Colisões. Teorias com base termodinâmica. Teoria do Estado de Transição; 9. Cinética de reações complexas: tipos de reação. Velocidade de reação para um mecanismo. Reações simultâneas e consecutivas. Tratamento do estado estacionário. Etapa determinante da velocidade. Reações em cadeia. Reações explosivas. Reações unimoleculares em fase gasosa. A hipótese de Lindemann–Christiansen; 10. Cinética de reações em superfície: adsorção com dissociação e competitiva. Mecanismos. Reações unimoleculares em superfícies. Reações bimoleculares. Reação entre duas moléculas adsorvidas. Reação entre uma molécula adsorvida e uma fase gasosa; 11. Catálise homogênea: mecanismos gerais. Tratamento de equilíbrio. Tratamento de estado estacionário. Energia de ativação para reações catalisadas. Catálise ácido-base. Catálise ácidobase geral. Mecanismos. Atividade catalítica e força do ácido ou base. Catálise enzimática. Influência da concentração do substrato. Influência do pH. Influência de temperatura. Mecanismos. Bibliografia: - ATKINS, Peter W. Físico-Química. Rio de Janeiro: L.T.C., 1999. v. 3. - MOORE, W. J. Físico-Química. São Paulo: EDUSP, 1976. - PILLA, L. Físico-Química. Rio de Janeiro: L.T.C., 1999. v. 2. GFQ00019 Página 2 de 2
Baixar