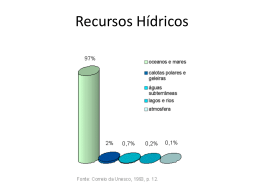
SISTEMA DE PARAFUSO CANULADO PT 137183-1 Os seguintes idiomas estão incluídos nesta embalagem: English (en) Español (es) Türkçe (tk) Deutsch (de) Italiano (it) Distribuído por: Wright Medical Technology, Inc. 5677 Airline Rd. Arlington, TN 38002 Tel: 901-867-9971 www.wmt.com P Wright Medical EMEA Krijgsman 11 1186 DM Amstelveen The Netherlands Nederlands (nl) Português (pt) Français (fr) 中文-Chinese (sch) C 0124 Fabricado por: aap Implantate AG Lorenzweg 5 12099 Berlin, Germany Tel.:+49 (0) 30 750 19 0 Fax:+49 (0) 30 750 19 222 www.aap.de INSTRUÇÕES DE UTILIZAÇÃO DESCRIÇÃO: SISTEMA: SISTEMA DE PARAFUSO CANULADO Materiais: • Liga metálica de CrNi em conformidade com ISO 5832-1 e ASTM F 138 / ASTM F 139 • Liga metálica de titânio em conformidade com ISO 5832-3 e ASTM F 136 Advertências e precauções Os parafusos canulados e os fios-guia são fornecidos pela aap não estéreis e devem ser imperativamente preparados antes da sua utilização. Estes produtos destinam-se a uma única utilização. A reutilização, incluindo a utilização de fios Kirschner como fios-guia para parafusos canulados, encontra-se proibida pela aap. Os implantes devem ser utilizados apenas no contexto da função a que se destinam. Em geral, antes do procedimento, o cirurgião tem de estar familiarizado com o procedimento cirúrgico, especialmente com a técnica cirúrgica relevante para os implantes utilizados. A selecção e colocação correctas do implante são extremamente importantes. Recomendamos o planeamento pré-operatório para determinação dos tamanhos mais apropriados assim como da posição final do implante. É possível encontrar instruções relativas à combinação de instrumentos na Técnica Cirúrgica correspondente. A aap não testou combinações que utilizem implantes e instrumentos de outros fabricantes e qualquer combinação é efectuada mediante a conta e risco do cirurgião. O sistema de parafuso canulado aap não foi avaliado relativamente à segurança e compatibilidade em meio de RM. O sistema de parafuso canulado aap não foi testado relativamente ao aquecimento ou migração em meio de RM. Recomendações relativas a fragmentos do dispositivo 1. Utilize os dispositivos médicos de acordo com as indicações constantes da documentação e as instruções de utilização do fabricante, especialmente durante a introdução e a remoção. 2. Inspeccione os dispositivos antes da utilização para detectar danos que possam ter ocorrido durante o envio ou o armazenamento ou quaisquer defeitos ao abrir a embalagem que possam aumentar a probabilidade de fragmentação durante um procedimento. 3. Inspeccione os dispositivos imediatamente depois de serem removidos do doente para detectar quaisquer sinais de quebra ou fragmentação. 4. Se o dispositivo estiver danificado, guarde-o para ajudar na análise da ocorrência pelo fabricante. 5. Considere cuidadosamente os riscos e benefícios de recuperar ou deixar o fragmento no doente e discuta-os com o doente (se possível). 6. Aconselhe o doente acerca da natureza e segurança de fragmentos de dispositivo não recuperados, incluindo a seguinte informação: a. a composição material do fragmento (se conhecida); b. o tamanho do fragmento (se conhecido); c. a localização do fragmento; d. os potenciais mecanismos conducentes a lesões como, por exemplo, migração ou infecção; e. Procedimentos ou tratamentos que devem ser evitados, tais como exames de RMN no caso de fragmentos metálicos. Isto pode ajudar a reduzir a possibilidade de ocorrência de uma lesão grave devido ao fragmento. Indicações Em princípio, a indicação para osteossíntese deve apenas ser feita quando é aparente que não se pode esperar que outros métodos conservadores resultem em sucesso. Parafusos canulados Os parafusos canulados aap destinam-se a ser utilizados sobre um pino ou fio guia para fixação de fractura óssea e fixação de fragmento ósseo. É possível utilizar anilhas da aap com os parafusos em determinadas aplicações. • Reconstruções de articulações / fracturas minimamente invasivas • Fracturas de articulações de múltiplos fragmentos • Fracturas da metáfise simples • Fracturas da epífise simples • Fracturas da cabeça do úmero • Fracturas da cabeça da tíbia • Fracturas Cooper da tíbia • Fracturas do rádio • Fracturas do pulso, anca, cotovelo, ombro • Fracturas do escafóide e outras fracturas da mão • Fracturas metatársicas e outras fracturas do pé • Fixação de ligamento do úmero proximal • Lesões de avulsão do ligamento (apófise) • Fracturas dos ossos das pequenas articulações • Fracturas maleolares • Fracturas naviculares • Fracturas do calcâneo e do astrágalo • Artrodese da articulação do tornozelo • Fractura de avulsão e do 5º metatarso • Fracturas da região társica Produtos de fios • Fio-guia em osteo-síntese por parafuso canulado Contra-indicações Inflamação, sepsia e osteomielite são contra-indicações absolutas. Todas as aplicações não definidas pelas indicações consideram-se contra-indicadas. Além disso, o sucesso cirúrgico pode ser adversamente afectado por: • infecções agudas ou crónicas, locais ou sistémicas • patologias vasculares, musculares ou neurológicas que comprometam a extremidade em questão • todas as patologias concomitantes que possam afectar o funcionamento do implante • osteopatias com redução da substância óssea, tal como a osteoporose grave • qualquer perturbação mental ou neuromuscular que possa resultar num risco inaceitável de falha no momento da fixação ou complicações no tratamento pós-operatório • suspeita ou conhecimento de sensibilidade ao metal • corpulência: um doente com excesso de peso ou corpulento pode causar tamanho esforço no implante que torne possível a ocorrência de estabilização ou falha do implante • sempre que a utilização do implante entre em conflito com as estruturas anatómicas do estado fisiológico. Outros problemas médicos ou cirúrgicos prévios que possam comprometer o procedimento potencialmente benéfico, como por exemplo: • a presença de tumores • anomalias congénitas • patologias imunossupressoras • aumento das taxas de sedimentação não explicável mediante outras patologias • aumento da contagem de leucócitos • mudança para a esquerda pronunciada na contagem do diferencial de leucócitos. Informações para o doente Doentes com hábitos tabágicos ou que utilizem outros produtos que contenham nicotina apresentam frequentemente um maior risco de pseudoartroses. O doente deve ser informado das limitações de suporte de cargas do implante, em particular dos efeitos previsíveis nos resultados cirúrgicos na eventualidade de não conformidade com as instruções pós-operatórias do cirurgião. Além disso, o doente deve ser informado de que a duração previsível dos implantes utilizados depende do seu peso e do nível de actividade física; e de que a capacidade de suporte de cargas de um implante não é comparável à de um osso saudável. Não é possível excluir danos nos tecidos nas imediações do implante na eventualidade de uma exposição profissional a fortes campos electromagnéticos alternados, sendo necessários cuidados futuros assim como o recurso à adopção de medidas pelo doente. Todas as informações fornecidas ao doente têm de ser documentadas. Possíveis complicações • desprendimento, deformação ou fractura do implante • infecções agudas de feridas pós-operatórias e infecções tardias com possibilidade de sepsia • migração, subluxação do implante com a resultante redução da amplitude do movimento • fracturas que resultem de cargas articulares unilaterais • trombose e embolismo • hematoma de ferida e cicatrização de ferida retardada • perturbação neurológica funcional temporária e prolongada • reacções de tecidos como resultado de alergia ou de reacção a corpo estranho a partículas desalojadas • corrosão com reacção de tecido e dor localizadas • dor, uma sensação de mal-estar ou sensações anormais causadas pelo implante utilizado • perda óssea devido à protecção contra esforços Todas as possíveis complicações aqui indicadas não são apenas típicas de produtos aap, mas observam-se, em princípio, com qualquer implante. Informe imediatamente a aap assim que ocorrerem complicações associadas aos implantes ou instrumentos cirúrgicos utilizados. No caso de se suspeitar da existência de uma relação causal entre a falha prematura de um implante e a sua geometria, a qualidade da superfície ou a estabilidade mecânica, envie-o para a aap limpo, esterilizado e desinfectado. O fabricante não pode aceitar quaisquer outras devoluções de implantes utilizados. O cirurgião responsabilizado pelas complicações associadas com assepsia inadequada, preparação inadequada do leito do implante ósseo, no caso dos implantes, indicação ou técnica cirúrgica incorrectas ou informação incorrecta do paciente com o consequente comportamento incorrecto do mesmo. Embalagem e esterilidade Todos os dispositivos médicos aap são fornecidos não estéreis; é imperativa a sua preparação antes da utilização. O fabricante garante a limpeza dos dispositivos médicos supra-mencionados dentro das respectivas embalagens não danificadas originais apenas até ao momento em que sejam abertas. O cirurgião é responsável por manter a assepsia entre o doente e o instrumento. Antes de abrir a embalagem do produto, inspeccione-a para detecção de danos. Os dispositivos médicos provenientes de embalagens danificadas não devem ser utilizados. Manuseamento Ao remover os dispositivos médicos da embalagem, inspeccione a integridade dos mesmos e a correspondência do tipo e tamanho do dispositivo com as indicações no rótulo. Dispositivos médicos danificados não deverão ser utilizados. A aap é a única responsável pelos dispositivos médicos e pela respectiva apresentação. Qualquer alteração efectuada aos mesmos resulta num dispositivo médico pelo qual a aap não assume qualquer responsabilidade. O conjunto de instrumento necessário pode ser encomendado à Wright Medical Technology, Inc. Consulte a Técnica Cirúrgica relativamente a detalhes adicionais acerca da implantação dos componentes e acerca do conjunto de instrumento. Preparação de dispositivos médicos Siga estas instruções de preparação de modo a manter o valor dos seus dispositivos médicos. As inúmeras possibilidades de preparação baseiam-se nas compatibilidades dos materiais dos respectivos dispositivos médicos. Uma preparação bem sucedida é da exclusiva responsabilidade do utilizador. Ao fazê-lo, cumpra especialmente as instruções e especificações indicadas nas instruções de utilização e nas normas e regulamentos estatutários nacionais relevantes. Manuseamento de dispositivos médicos Está proibido o reprocessamento de implantes utilizados ou de implantes que tenham entrado em contacto com fluidos corporais. Mesmo assim, todos os dispositivos têm de ser limpos antes da sua esterilização e utilização. As tampas e películas protectoras, assim como outros elementos de protecção para transporte devem ser completamente removidos. Limpeza 1. Desmonte todos os componentes de acordo com as instruções do fabricante (caso seja adequado). 2. Enxagúe com água fria da torneira para remover a contaminação grosseira. 3. Mergulhe durante 5 minutos numa solução detergente enzimática preparada de acordo com as instruções do fabricante. 4. Esfregue meticulosamente com uma escova macia e / ou escovilhão; com uma seringa, irrigue repetidamente os lúmenes muito estreitos com solução detergente enzimática. 5. Enxagúe com água da torneira fria durante no mínimo um minuto; com uma seringa, irrigue repetidamente os lúmenes muito estreitos. 6. Mergulhe durante 5 minutos numa solução detergente preparada de acordo com as instruções do fabricante. 7. Esfregue meticulosamente com uma escova macia e / ou escovilhão; com uma seringa, irrigue repetidamente os lúmenes muito estreitos com solução detergente. 8. Enxagúe minuciosamente / irrigue com água desionizada ou de osmose inversa. 9. Proceda à sonicação durante um mínimo de 10 minutos numa solução detergente enzimática preparada de acordo com as instruções do fabricante. 10. Enxagúe minuciosamente / irrigue com água desionizada ou de osmose inversa. 11. Seque com um pano limpo, descartável, que seja macio e absorvente. 12. Inspeccione visualmente quanto à limpeza. Todas as superfícies visíveis, internas e externas, devem ser visualmente inspeccionadas. Se necessário, volte a limpar até estar visivelmente limpo. Observação: As escovas (ex., escovilhões) podem ser usadas para limpar a maioria dos lúmenes; no entanto, recomenda-se a utilização de uma seringa para irrigar os lúmenes estreitos com diâmetros inferiores ou iguais a 1,04 mm. Esterilização As condições mínimas de esterilização a vapor recomendadas para parafusos canulados de cabeça Darco são as seguintes: 1. Enrole duas vezes o componente em invólucro CSR aprovado pela FDA ou num material de embrulho não-tecido semelhante, indicado para uso médico. 2. Esterilize em autoclave de acordo com os seguintes parâmetros: Esterilização por vapor Tipo de ciclo Parâmetro Temperatura mínima Pré-vácuo 132 ˚C (270 ˚F) Temperatura de exposição 132 ˚C (270 ˚F) Tempo de exposição 4 minutos Tempo de secagem 20 minutos 3. Após a esterilização, retire o componente da sua embalagem recorrendo a uma técnica estéril aceite com luvas sem pó. Certifique-se de que os implantes se encontram à temperatura ambiente antes da implantação. Evite o contacto com objectos duros que possam causar danos. Estas recomendações são consistentes com as normas AAMI ST79:2006/A1:2008 & A2:2009 e foram desenvolvidas e testadas usando equipamento específico. Devido a variações de ambiente e equipamento, é necessário comprovar que estas recomendações são eficazes na esterilização no seu ambiente. Se ocorrerem alterações nas condições de processamento, nos materiais de embrulho ou no equipamento, a eficácia do processo de esterilização deverá ser comprovada. Cuidados / inspecção • Deixe que os dispositivos médicos arrefeçam à temperatura ambiente. • Implantes que tenham entrado em contacto com fluidos orgânicos nunca deverão ser reutilizados. Certifique-se de que serão devolvidos em conformidade com um protocolo validado de forma a não transmitirem doenças infecciosas. • Separe e substitua dispositivos médicos danificados e com defeitos. Armazenamento O utilizador deve evitar todos os efeitos que possam afectar a marcação do produto ou a duração dos dispositivos médicos, a superfície do dispositivo médico ou a geometria do mesmo, tais como agitação, esforços, calor, radiação ultravioleta, humidade, etc., desnecessários. Observações finais As instruções supra-referidas foram validadas pela Wright e pela aap como preparação adequada para utilização repetida dos instrumentos, mas não pode substituir uma descrição detalhada do processo, visto não ser possível descrever de forma detalhada a variedade de procedimentos de preparação utilizados a nível mundial. O indivíduo que efectua a preparação é responsável pela obtenção do resultado pretendido na preparação real utilizando equipamento, materiais e pessoal existente nas instalações de preparação. Para este efeito, é necessário realizar uma validação, assim como inspecções de rotina, do processo no local. O desrespeito das instruções fornecidas por parte do responsável pelo processamento deve ser documentado e examinado relativamente à respectiva eficácia e a possíveis consequências adversas. REF.: WM 7022-00 (137183-1) REV.: 5 / 05.12.2010
Baixar