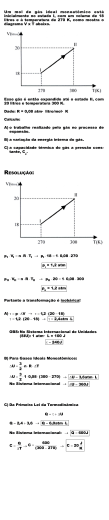
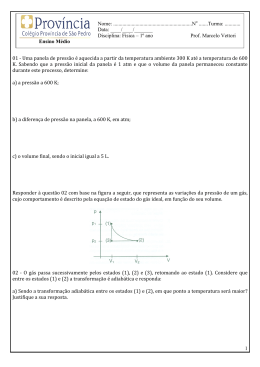
1) Os avanços tecnológicos na eletrônica levaram à invenção do espectrômetro de massa, um aparelho que determina a massa de um átomo. Um mineiro, procurando ouro em um riacho coleta, 10 g de peças finas de ouro conhecidas como “pó de ouro”. Sabendo que a massa de um átomo de ouro é 3,27 ⋅ 10−25 kg, calcule quantos átomos de ouro o mineiro coletou. 2) Considere que a massa de uma gota de água é de 0,05 g. Calcule a quantidade de mols (n) que existe nessa gota de água. Dado: massa molecular da água é igual a 18 u. 3) Segundo dados da CETESB, deve ser decretado Estado de Emergência quando é atingida a concentração de 46mg de monóxido de carbono (CO) por m¤ de ar; nessa situação, são proibidas as atividades industriais e a circulação de veículos a gasolina. Calcule o número de moles de CO, por metro cúbico de ar, para a situação anterior. 4) Calcule a quantidade em mols e o número de moléculas encontrados em 90 g de ácido acético (CH3COOH). 5) Sabendo-se que a massa molar da água é igual a 18g/mol. Determine, em uma caixa d'água com 1000 kg do tão precioso líquido, a quantidades de mols desta substância. 6) O pneu de um carro estacionado tem uma pressão de 2atm, quando a temperatura é de 9o C. Depois do veículo correr em alta velocidade, a temperatura do pneu sobe a 37o e seu volume aumenta de 10%. Qual a nova pressão do pneu? 7) Um botijão de oxigênio de 20L contém n mols do gás a uma pressão de 10 atm e temperatura de 27o C. Utilizou-se parte do gás, com o que a pressão caiu para 6 atm (à mesma temperatura). Quantas gramas do gás foram utilizadas? Dado: R = 0,082 atm.l/mol.K 8) Uma certa quantidade de gás ocupa um volume de 10 L e sua temperatura é de 450 K. Sem que a pressão mude, sua temperatura é baixada para 300 K. Determine o volume do gás nessa nova situação. 9) Um recipiente a 27oC contém 60 litros de um certo gás exercendo a pressão de 1 atm. Calcule a pressão exercida por esta mesma massa de gás a 27o C em um recipiente com capacidade para 15 litros. 10) Se um certo gás contido em um compartimento e exercendo pressão de 10 cmHg for comprimido de maneira a ocupar um vigésimo do seu volume inicial, qual será a pressão final se a transformação for isotérmica? 11) Sob pressão de 5,0 atmosferas, certa massa de gás perfeito ocupa o volume de 50 litros à temperatura de 100 K. Responda: a) Sob que pressão o gás passa a ocupar o volume de 100 litros, quando sua temperatura for modificada para 400 K? b) Em que temperatura o volume do gás será de 20 litros, se a pressão for modificada para 2,0 atmosferas? c) Que volume o gás passará a ocupar se a temperatura for alterada para 200 K e a pressão para 4,0 atmosferas? 12) Um gás é aquecido a volume constante. A pressão exercida pelo gás sobre as paredes do recipiente aumenta porque: a) a distancia média entre as moléculas aumenta. b) a massa específica das moléculas aumenta com a temperatura. c) as moléculas passam a se chocar com maior frequência com as paredes do recipiente. d) a perda de energia cinética das moléculas nas colisões com a parede aumenta. 13) Um mergulhador, em um lago, solta uma bolha de ar de volume V a 5,0 m de profundidade. A bolha sobe até a superfície, onde a pressão é a pressão atmosférica. Considere que a temperatura da bolha permanece constante e que a pressão aumenta cerca de 1,0 atm a cada 10 m de profundidade. Nesse caso, o valor do volume da bolha na superfície é, aproximadamente, a) 0,67 V b) 1,5 V c) 2,0 V d) 0,50 14) Um gás à pressão P1 e temperatura de 20º C é aquecido até 100º C em um recipiente 3 fechado de um volume 20cm . Qual será a pressão do gás a 100º C? Despreze a dilatação do recipiente. a) P2 = P1 b) P2 = 2 P1 c) P2 = 1,27 P1 d) P2 = 5 P1 15) A matéria se apresenta em três estados físicos: sólido, líquido e gasoso. Em relação aos estados físicos da matéria, pode-se afirmar: a) Os sólidos possuem forma indefinida. b) O estado gasoso é o mais organizado. c) As partículas que constituem um material sólido estão bem organizadas e interagem fortemente umas com as outras. d) A força de atração entre as moléculas dos materiais no estado líquido é mais intensa que no estado sólido. 16) Qual é a temperatura de um gás (em graus celsius), sabendo que 2,5 mols desse gás ocupam o volume de 50 litros à pressão de 1246 mmHg na referida temperatura? 17) Certa massa gasosa ocupa um volume de 10,0 L a –23 oC e 1140 mmHg. Qual será o volume, em litros, dessa mesma massa gasosa a 0 oC e 1 atm? Dados : Massa molecular da glicose = 180 g.mol-1. 18) Qual a massa molecular de um gás, sabendo que 0,800 g desse gás ocupa o volume de 1,12 L a 273 oC e 2,00 atm? 19) 670 g de um certo gás Yn ocupam 0,2 m3 medidos nas CNTP. Se o peso atômico de Y é 15,0 u, então o gás tem que fórmula molecular? 20) Há dois recipientes distintos, A e B, de capacidade 8,2 L. Um deles contém gás oxigênio, e o outro gás ozônio (O3). Sabendo-se que o recipiente A contém uma massa de 24 gramas de gás a uma pressão de 1,5 atm e à temperatura de 27°C, identifique em que recipientes estão contidos os gases oxigênio e ozônio. Justifique sua resposta demonstrando os cálculos. Dados : massa atômica do oxigênio=16 g/mol. 21) Enquanto descansa, o corpo de uma pessoa consome 200 mL de oxigênio por hora, a 25oC e 1 atm, por kg de massa do corpo. Quantos mols de O2 são consumidos por uma pessoa que pesa 70 kg, em uma hora de descanso? Dado: R = 0,082 L.atm/mol.K 22) 22 g de um gás estão contidos em um recipiente de volume igual a 17,5 L, a uma temperatura de 77ºC e pressão de 623 mmHg. Este gás deve ser: Dados: H = 1, O = 16, N = 14, S = 32, C = 12 a) NO b) H2S c) SO2 d) CO2 e) NH3 23) Qual a massa molecular de 45g de uma substância gasosa que está dentro de um recipiente de 3 litros a uma pressão de 5atm e a uma temperatura de 27°C? Dado: R = 0,082 atm.L/mol.K 24) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H2SO4) foram derramadas pelo navio Bahamas no litoral do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante. Para isso podese, por exemplo, lançar calcário, minério rico em carbonato de cálcio (CaCO3), na região atingida. A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas dessas substâncias é: H2SO4 1 tonelada + reage com CaCO3 → CaSO4 + H2O + sólido sedimentado CO2 gás Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse número de caminhões, cada um com carga de 30 toneladas, seria próximo de a) 100. b) 200. c) 300. d) 400. e) 500. 25) Atualmente, sistemas de purificação de emissões poluidoras estão sendo exigidos por lei em um número cada vez maior de países. O controle das emissões de dióxido de enxofre gasoso, provenientes da queima de carvão que contém enxofre, pode ser feito pela reação desse gás com uma suspensão de hidróxido de cálcio em água, sendo formado um produto não poluidor do ar. A queima do enxofre e a reação do dióxido de enxofre com o hidróxido de cálcio, bem como as massas de algumas das substâncias envolvidas nessas reações, podem ser assim representadas: enxofre (32 g) + oxigênio (32 g) → dióxido de enxofre (64 g) dióxido de enxofre (64 g) + hidróxido de cálcio (74 g) → produto não poluidor Dessa forma, para absorver todo o dióxido de enxofre produzido pela queima de uma tonelada de carvão (contendo 1% de enxofre), é suficiente a utilização de uma massa de hidróxido de cálcio de aproximadamente: a) 23 kg. b) 43 kg. c) 64 kg. d) 74 kg. e) 138 kg.
Baixar